حرارة نوعية
| الديناميكا الحرارية |
|---|
 |
الحرارة النوعية Heat capacity هى كمية الحرارة اللازمة لتتغير درجه حرارة وحدة الكتلة من الجسم بمقدار درجه واحدة. ويرمز لها بالرمز (c) ووحداتها في النظام الدولي هى (J kg-1 K-1)
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تعريفات مرتبطة
يقصد بالحرارة الكتلية الحرارة النوعية، وذلك للتأكيد على ارتباط المصطلح بواحدة الكتلة من المادة ، مثل الغرام أو الكيلو غرام، إضافة إلى اختلافها باختلاف نوع المادة، فتعرف بأنها كمية الحرارة اللازمة لرفع درجة حرارة واحدة الكتلة درجة واحدة. لذلك يمكن أن تختلف قيمها المعطاة بالجداول باختلاف جملة الواحدات المستخدمة وباختلاف السلم الحراري الذي يعبر عن درجة الحرارة. ليس هذا فحسب، بل تبين أن هذه الكمية تختلف، بصورة عامة، باختلاف موقع الدرجة على السلم الحراري. وأوضح مثال على ذلك الواحدة التي تقاس بها كمية الحرارة، فقد عرفت بأنها كمية الحرارة اللازمة لرفع درجة حرارة غرام واحد من الماء درجة مئوية (سلزيوس) واحدة، وسميت الحريرة calory؛ إلا أن بعضهم يستخدم الكلمة مقابل كتلة قدرها كيلوغرام، ويسميها بعضهم الحريرة الكبيرة أو الحرة منعاً للالتباس. ولما زادت دقة القياسات تبين أنها تتغير تغيراً طفيفاً عند قياسها بين 14 ْ و15 ْس عنه عندما تقاس بين 70 و71 ْ س مثلاً، فسميت لذلك حريرة الدرجة 15.
ثمة سبب آخر، في الواقع، لإظهار الكتلة هو اكتشاف تشابه سلوك المواد المختلفة عندما تؤخذ جزيئة غرامية من أي مادة أو ما يسمى المول mole، فعرّفت الحرارة المولية؛ كأن نأخذ 63غراماً من النحاس و نقارن سلوكها الحراري مع 27غراماً من الألمنيوم، فنجد تقارباً بين كميتي الحرارة اللازمتين لتغيير درجتيهما درجة واحدة، قرب درجة الحرارة العادية. ويكون التقارب أوضح في حالة الغازات، غير أنه يجب أن نميز هنا بين إجراء القياس مع إبقاء الضغط ثابتاً، فنرمز لها بـCp ، أو إجرائه مع إبقاء الحجم ثابتا، ونرمز لها بـCv. ففي حين يكون الاختلاف بين القياسين في حالة الأجسام الصلبة طفيفاً، قرب درجات الحرارة العادية، فهو من مرتبة قيمة Cv في حالة الغازات.
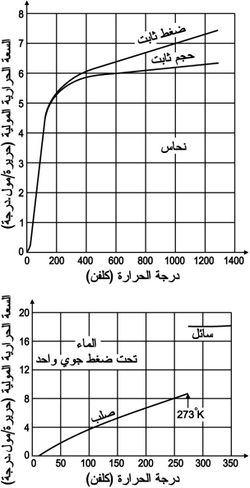
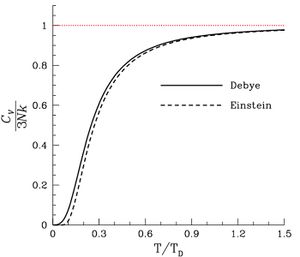
إن تغير Cv أو Cp مع تغير درجة الحرارة يفرض تعريفهما تعريفاً تفاضلياً كنهاية حاصل قسمة مقدارين صغيرين جداً dQ على dT. إذ يجري القياس عادة بأخذ m غراماً من المادة وإعطائها كمية من الحرارة ثم يحدد تغير درجة حرارتها الناتج، فتكون النسبة بينهما هي ما يعرف بالسعة الحرارية للكتلة heat capacity وبالتقسيم ثانية على m نحصل على الحرارة الكتلية الوسطية، يستخلص بعدئذ حسابياً الحرارة الكتلية أو الحرارة المولية عند كل درجة من درجات الحرارة. يبين الشكل-1- تغيرات الحرارة المولية للنحاس ممثلاً للأجسام الصلبة، وللماء موضحاً الفرق بين القيمتين عند الانتقال إلى الحالة الصلبة. و يظهر في الشكل اقتراب الحرارة المولية أو الحرارة الكتلية من الصفر قرب الصفر المطلق.
تساعد معرفة الحرارة الكتلية للمواد المختلفة على اختيار مادة مناسبة للتبريد أو لاستخدامها في المبادلات الحرارية، إضافة إلى معرفة ناقليتها الحرارية. فإن كبر الحرارة الكتلية لمصهور الصوديوم هو سبب استخدامه في تبريد المفاعلات النووية، كما أن تفرد الماء بحرارة كتلية عالية بين السوائل تكسبه المزيد من الخواص المميزة الأخرى.[1]
السعة الحرارية
هى كميه الحراره Q اللازمة لرفع درجة حرارة الجسم كله درجة واحدة كلفن
ووحدتها جول/كلفن
الحرارة النوعية لمادة C
هى كميه الحراره C التي الازمة لرفع درجة حرارة كيلوجرام واحد من المادة درجة واحدة كلفن.
إذن فان الحراره النوعيه تعرف بانها السعه الحراريه لوحدة الكتل.
ووحدتها جول/ كجم كلفن
الحرارة النوعية هى خاصية مميزة لمادة الجسم حيث لا تتأثر بكتلته .
الحرارة الكامنة
هى كمية الحرارة اللازمة لتغيير حالة وحدة الكثافة من المادة من حالة إلى أخرى دون تغيير في درجة الحرارة. فعند تحول المادة من الحالة الصلبة إلى الحالة السائلة، بالحرارة الكامنة للانصهار، وعند تحول الماده من الحالة السائلة إلى الحالة الصلبة تسمى بالحرارة الكامنة للتجمد، و في حاله تحول المادة من الحالة السائلة إلى الحالة الغازية تسمى بالحرارة الكامنة للتصعيد.
Extensive and intensive quantities
علم القياس
Calculation from first principles
العلاقات الحرارية وتحديد السعة الحرارية
العلاقة بين الحرارات النوعية
 مقالة مفصلة: العلاقات بين الحرارات النوعية
مقالة مفصلة: العلاقات بين الحرارات النوعية
الغاز المثالي
سعة الحرارة النوعية
الحرارة النوعية متعدد التوجه
أبعاد الحرارة النوعية
الحرارة النوعية في الصفر المطلق
الحرارة النوعية السلبية
نظرية الحرارة النوعية
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العوامل المؤثرة على الحرارة النوعية
الدرجات الحرة
 مقالة مفصلة: الدرجات الحرة (الفيزياء والكيمياء)
مقالة مفصلة: الدرجات الحرة (الفيزياء والكيمياء)
عوامل أخرى
روابط هيدروجينية
الشوائب
الحالة السهلة لغاز أحادي الذرة
| Monatomic gas | CV, m (J/(mol·K)) | CV, m/R |
|---|---|---|
| He | 12.5 | 1.50 |
| Ne | 12.5 | 1.50 |
| Ar | 12.5 | 1.50 |
| Kr | 12.5 | 1.50 |
| Xe | 12.5 | 1.50 |
غاز ثنائي الذرة
at standard temperature (25 oC = 298 K)
| Diatomic gas | CV, m (J/(mol·K)) | CV, m / R |
|---|---|---|
| H2 | 20.18 | 2.427 |
| CO | 20.2 | 2.43 |
| N2 | 19.9 | 2.39 |
| Cl2 | 24.1 | 3.06 |
| Br2 (vapour) | 28.2 | 3.39 |
الغازات العامة
تخزين الطاقة في درجات حرة
تأثير مستويات الطاقة في كمية تخزينها في درجات حرة
وضع تخزين الطاقة "التجميد" لتعديل درجات الحرارة
المرحلة الصلبة
 مقالات مفصلة: آينشتاين
مقالات مفصلة: آينشتاين - نموذج ديباي
- النظرية الحركية للمواد الصلبة
جدول قدرات الحرارة النوعية
| Substance | Phase | (mass) specific heat capacity cp or cm J·g−1·K−1 |
Constant pressure molar heat capacity Cp,m J·mol−1·K−1 |
Constant volume molar heat capacity Cv,m J·mol−1·K−1 |
Volumetric heat capacity Cv J·cm−3·K−1 |
Constant vol. atom-molar heat capacity in units of R Cv,m(atom) atom-mol−1 |
|---|---|---|---|---|---|---|
| Air (Sea level, dry, 0 °C (273.15 K)) |
gas | 1.0035 | 29.07 | 20.7643 | 0.001297 | ~ 1.25 R |
| Air (typical room conditionsA) |
gas | 1.012 | 29.19 | 20.85 | 0.00121 | ~ 1.25 R |
| Aluminium | solid | 0.897 | 24.2 | 2.422 | 2.91 R | |
| Ammonia | liquid | 4.700 | 80.08 | 3.263 | 3.21 R | |
| Animal tissue (incl. human)[4] |
mixed | 3.5 | 3.7* | |||
| Antimony | solid | 0.207 | 25.2 | 1.386 | 3.03 R | |
| Argon | gas | 0.5203 | 20.7862 | 12.4717 | 1.50 R | |
| Arsenic | solid | 0.328 | 24.6 | 1.878 | 2.96 R | |
| Beryllium | solid | 1.82 | 16.4 | 3.367 | 1.97 R | |
| Bismuth[5] | solid | 0.123 | 25.7 | 1.20 | 3.09 R | |
| Cadmium | solid | 0.231 | 26.02 | 3.13 R | ||
| Carbon dioxide CO2[6] | gas | 0.839* | 36.94 | 28.46 | 1.14 R | |
| Chromium | solid | 0.449 | 23.35 | 2.81 R | ||
| Copper | solid | 0.385 | 24.47 | 3.45 | 2.94 R | |
| Diamond | solid | 0.5091 | 6.115 | 1.782 | 0.74 R | |
| Ethanol | liquid | 2.44 | 112 | 1.925 | 1.50 R | |
| Gasoline (octane) | liquid | 2.22 | 228 | 1.64 | 1.05 R | |
| Glass[5] | solid | 0.84 | ||||
| Gold | solid | 0.129 | 25.42 | 2.492 | 3.05 R | |
| Granite[5] | solid | 0.790 | 2.17 | |||
| Graphite | solid | 0.710 | 8.53 | 1.534 | 1.03 R | |
| Helium | gas | 5.1932 | 20.7862 | 12.4717 | 1.50 R | |
| Hydrogen | gas | 14.30 | 28.82 | 1.23 R | ||
| Hydrogen sulfide H2S[6] | gas | 1.015* | 34.60 | 1.05 R | ||
| Iron | solid | 0.450 | 25.1[بحاجة لمصدر] | 3.537 | 3.02 R | |
| Lead | solid | 0.129 | 26.4 | 1.44 | 3.18 R | |
| Lithium | solid | 3.58 | 24.8 | 1.912 | 2.98 R | |
| Lithium at 181 °C[7] | liquid | 4.379 | 30.33 | 2.242 | 3.65 R | |
| Magnesium | solid | 1.02 | 24.9 | 1.773 | 2.99 R | |
| Mercury | liquid | 0.1395 | 27.98 | 1.888 | 3.36 R | |
| Methane at 2 °C | gas | 2.191 | 35.69 | 0.66 R | ||
| Methanol (298 K)[8] | liquid | 2.14 | 68.62 | 1.38 R | ||
| Nitrogen | gas | 1.040 | 29.12 | 20.8 | 1.25 R | |
| Neon | gas | 1.0301 | 20.7862 | 12.4717 | 1.50 R | |
| Oxygen | gas | 0.918 | 29.38 | 21.0 | 1.26 R | |
| Paraffin wax C25H52 |
solid | 2.5 (ave) | 900 | 2.325 | 1.41 R | |
| Polyethylene (rotomolding grade)[9] |
solid | 2.3027 | ||||
| Polyethylene (rotomolding grade)[9] |
liquid | 2.9308 | ||||
| Silica (fused) | solid | 0.703 | 42.2 | 1.547 | 1.69 R | |
| Silver[5] | solid | 0.233 | 24.9 | 2.44 | 2.99 R | |
| Sodium | solid | 1.230 | 28.23 | 3.39 R | ||
| Tin | solid | 0.227 | 27.112 | 3.26 R | ||
| Titanium | solid | 0.523 | 26.060 | 3.13 R | ||
| Tungsten[5] | solid | 0.134 | 24.8 | 2.58 | 2.98 R | |
| Uranium | solid | 0.116 | 27.7 | 2.216 | 3.33 R | |
| Water at 100 °C (steam) | gas | 2.080 | 37.47 | 28.03 | 1.12 R | |
| Water at 25 °C | liquid | 4.1813 | 75.327 | 74.53 | 4.1796 | 3.02 R |
| Water at 100 °C | liquid | 4.1813 | 75.327 | 74.53 | 4.2160 | 3.02 R |
| Water at −10 °C (ice)[5] | solid | 2.11 | 38.09 | 1.938 | 1.53 R | |
| Zinc[5] | solid | 0.387 | 25.2 | 2.76 | 3.03 R | |
| Substance | Phase | Cp J/(g·K) |
Cp,m J/(mol·K) |
Cv,m J/(mol·K) |
Volumetric heat capacity J/(cm3·K) |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
سعة الحرارة النوعية لمواد البناء
(Usually of interest to builders and solar designers)
| Substance | Phase | cp J/(g·K) |
|---|---|---|
| Asphalt | solid | 0.920 |
| Brick | solid | 0.840 |
| Concrete | solid | 0.880 |
| Glass, silica | solid | 0.840 |
| Glass, crown | solid | 0.670 |
| Glass, flint | solid | 0.503 |
| Glass, pyrex | solid | 0.753 |
| Granite | solid | 0.790 |
| Gypsum | solid | 1.090 |
| Marble, mica | solid | 0.880 |
| Sand | solid | 0.835 |
| Soil | solid | 0.800 |
| Sulphur Hexafluoride | gas | 0.664 |
| Wood | solid | 1.7 (1.2 to 2.3) |
| Substance | Phase | cp J/(g·K) |
انظر ايضا
- الحرارة
- حرارة كامنة
- Quantum statistical mechanics
- Heat capacity ratio
- Statistical mechanics
- Thermodynamic equations
- Thermodynamic databases for pure substances
- Heat equation
- Heat transfer coefficient
- Latent heat
- Material properties (thermodynamics)
- Joback method (Estimation of heat capacities)
- Specific melting heat
- Specific heat of vaporization
- Volumetric heat capacity
- Thermal mass
- R-value (insulation)
الهوامش
المصادر
- ^ فوزي عوض. "الحرارة الكتلية". الموسوعة العربية.
- ^
Reif, F. (1965). Fundamentals of statistical and thermal physics. McGraw-Hill. pp. 253–254. ISBN 07-051800-9.
{{cite book}}: Check|isbn=value: length (help) - ^
Charles Kittel; Herbert Kroemer (2000). Thermal physics. Freeman. p. 78. ISBN 0-7167-1088-9.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Page 183 in: Cornelius, Flemming (2008). Medical biophysics (6th ed.). ISBN 1-4020-7110-8. (also giving a density of 1.06 kg/L)
- ^ أ ب ت ث ج ح خ "Table of Specific Heats".
- ^ أ ب Young; Geller (2008). Young and Geller College Physics (8th ed.). Pearson Education. ISBN 0-8053-9218-1.
- ^ "Materials Properties Handbook" (PDF). UCLA.
- ^ "HCV (Molar Heat Capacity (cV)) Data for Methanol". Dortmund Data Bank Software and Separation Technology.
- ^ أ ب Crawford, R. J. Rotational molding of plastics. ISBN 1-59124-192-8.
وصلات خارجية