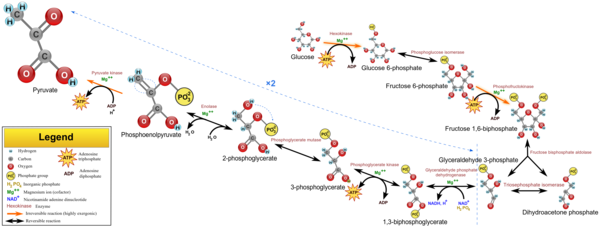
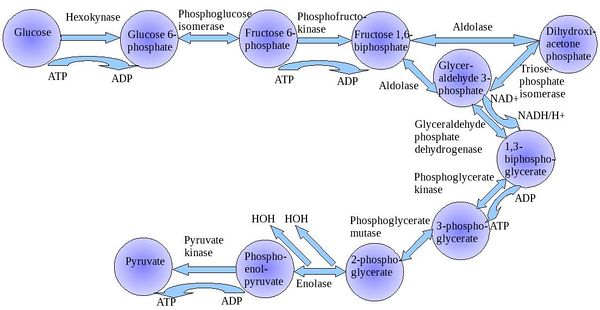
تحلل السكر
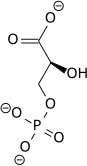
تحلل السكر Glycolysis [1] هو مسلك أيضي يتحول فيه الگلوكوز C6H12O6، إلى حمض الپيروڤيك، CH3COCOO− + H+. الطاقة الحرة المنطلقة أثناء هذه العملية تستخدم لتكوين مركبات عالية الطاقة (الأدينوسين ثلاثي الفوسفات) و NADH (reduced nicotinamide adenine dinucleotide).
يعتبر التحلل السكري الطريقة المثلى للحصول على الطاقة، وكنتيجة للتحلل اللاهوائي يمكن الحصول على جزيئين ATP وجزيئين NADH.
وتُعرف العملية اللاهوائية أيضا بعملية تحلل السكر، وهي التي تبدأ عادة أولا. حيث تقوم الخلايا بتفكيك أنواع محددة من السكريات والكربوهيدرات (گلوكوز والگليكوجين الموجودين في العضلات) لإطلاق الطاقة اللازمة لإعادة تخليق الأدينوسين ثلاثي الفوسفات. ولكن يسوء الرياضيين، أن الاستقلاب اللاهوائي للكربوهيدرات يمكن أن ينتج منه حمض اللبنيك lactic acid الذي يتراكم في العضلات خلال دقيقتين. ويسبب حمض اللبن وأيونات الهيدروجين حرقة مؤلمة في العضلات. ولكن هذا الحمض ومستقلباته، أي اللاكتات، التي تتراكم في العضلات لا تفسد الأداء في كل الحالات. فخلال التدريب تعتاد عضلات الصفوة من الرياضيين على تحمل مستويات عالية من اللاكتات التي تتولد أثناء التمارين العنيفة المركزة.
يمكن فصل مسار تحلل السكر الكامل إلى مرحلتين[2]:
- مرحلة التحضير - حيث يُستهلك الأدينوسين ثلاثي الفوسفات وبالتالي يدخل فيما يعرف بمرحلة الإستثمار.
- مرحلة السداد، حيث يتم إنتاج الأدينوسين ثلاثي الفوسفات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
نظرة عامة
تفاعلات التحلل السكري:
| د-[گلوكوز] | [پيروڤيات|پيروڤيكك] | ||||
| + 2 [NAD]+ + 2 [ADP] + 2 [P]i | 
|
2 | 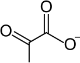
|
+ 2 [NADH] + 2 H+ + 2 [ATP] + 2 H2O |
شرح المسار
تسلسل المسار
مرحلة التحضير
تبدأ الخطوات الخمس الأولى أثناء مرحلة التحضير، عند إستهلاك الطاقة لتحويل الگلوكوز إلى جزيئي The first five steps are regarded as the preparatory (or investment) phase, since they consume energy to convert the glucose into two فوسفات السكر ثلاثي الگلوكوز[2] (G3P).
| The first step in glycolysis is phosphorylation of glucose by a family of enzymes called hexokinases to form glucose 6-phosphate (G6P). This reaction consumes ATP, but it acts to keep the glucose concentration low, promoting continuous transport of glucose into the cell through the plasma membrane transporters. In addition, it blocks the glucose from leaking out - the cell lacks transporters for G6P, and free diffusion out of the cell is prevented due to the charged nature of G6P. Glucose may alternatively be from the phosphorolysis or hydrolysis of intracellular starch or glycogen.
|
| ||||||||||||||||||||
| G6P is then rearranged into fructose 6-phosphate (F6P) by glucose phosphate isomerase. Fructose can also enter the glycolytic pathway by phosphorylation at this point.
The change in structure is an isomerization, in which the G6P has been converted to F6P. The reaction requires an enzyme, phosphohexose isomerase, to proceed. This reaction is freely reversible under normal cell conditions. However, it is often driven forward because of a low concentration of F6P, which is constantly consumed during the next step of glycolysis. Under conditions of high F6P concentration, this reaction readily runs in reverse. This phenomenon can be explained through Le Chatelier's Principle. Isomerization to a keto sugar is necessary for carbanion stabilization in the fourth reaction step (below). |
| ||||||||||||||||||||
| The energy expenditure of another ATP in this step is justified in 2 ways: The glycolytic process (up to this step) is now irreversible, and the energy supplied destabilizes the molecule. Because the reaction catalyzed by Phosphofructokinase 1 (PFK-1) is coupled to the hydrolysis of ATP, an energetically favorable step, it is, in essence, irreversible, and a different pathway must be used to do the reverse conversion during gluconeogenesis. This makes the reaction a key regulatory point (see below). This is also the rate-limiting step.
Furthermore, the second phosphorylation event is necessary to allow the formation of two charged groups (rather than only one) in the subsequent step of glycolysis, ensuring the prevention of free diffusion of substrates out of the cell. The same reaction can also be catalyzed by pyrophosphate-dependent phosphofructokinase (PFP or PPi-PFK), which is found in most plants, some bacteria, archea, and protists, but not in animals. This enzyme uses pyrophosphate (PPi) as a phosphate donor instead of ATP. It is a reversible reaction, increasing the flexibility of glycolytic metabolism.[3] A rarer ADP-dependent PFK enzyme variant has been identified in archaean species.[4] عوامل مساعدة: Mg2+ |
| ||||||||||||||||||||
| Destabilizing the molecule in the previous reaction allows the hexose ring to be split by aldolase into two triose sugars, dihydroxyacetone phosphate, a ketone, and glyceraldehyde 3-phosphate, an aldehyde. There are two classes of aldolases: class I aldolases, present in animals and plants, and class II aldolases, present in fungi and bacteria; the two classes use different mechanisms in cleaving the ketose ring.
Electrons delocalized in the carbon-carbon bond cleavage associate with the alcohol group. The resulting carbanion is stabilized by the structure of the carbanion itself via resonance charge distribution and by the presence of a charged ion prosthetic group. |
| ||||||||||||||||||||||||||
| Triosephosphate isomerase rapidly interconverts dihydroxyacetone phosphate with glyceraldehyde 3-phosphate (GADP) that proceeds further into glycolysis. This is advantageous, as it directs dihydroxyacetone phosphate down the same pathway as glyceraldehyde 3-phosphate, simplifying regulation. |
| ||||||||||||||||||||
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
مرحلة السداد
المرحلة الثانية من تحلل السكر تعرف باسم مرحلة السداد، وتتميز a net gain of the energy-rich molecules ATP and NADH[2]. Since glucose leads to two triose sugars in the preparatory phase, each reaction in the pay-off phase occurs twice per glucose molecule. This yields 2 NADH molecules and 4 ATP molecules, leading to a net gain of 2 NADH molecules and 2 ATP molecules from the glycolytic pathway per glucose.
| The triose sugars are dehydrogenated and inorganic phosphate is added to them, forming 1,3-bisphosphoglycerate.
The hydrogen is used to reduce two molecules of NAD+, a hydrogen carrier, to give NADH + H+ for each triose. Hydrogen atom balance and charge balance are both maintained because the phosphate (Pi) group actually exists in the form of a hydrogen phosphate anion (HPO42-),[5] which dissociates to contribute the extra H+ ion and gives a net charge of -3 on both sides. |
| ||||||||||||||||||||
| This step is the enzymatic transfer of a phosphate group from 1,3-bisphosphoglycerate to ADP by phosphoglycerate kinase, forming ATP and 3-phosphoglycerate. At this step, glycolysis has reached the break-even point: 2 molecules of ATP were consumed, and 2 new molecules have now been synthesized. This step, one of the two substrate-level phosphorylation steps, requires ADP; thus, when the cell has plenty of ATP (and little ADP), this reaction does not occur. Because ATP decays relatively quickly when it is not metabolized, this is an important regulatory point in the glycolytic pathway.
ADP actually exists as ADPMg-, and ATP as ATPMg2-, balancing the charges at -5 both sides. عوامل مساعدة: Mg2+ |
| ||||||||||||||||||||
| Phosphoglycerate mutase now forms 2-phosphoglycerate. |
| ||||||||||||||||||||
| Enolase next forms phosphoenolpyruvate from 2-phosphoglycerate.
عوامل مساعدة: 2 Mg2+: one "conformational" ion to coordinate with the carboxylate group of the substrate, and one "catalytic" ion that participates in the dehydration. |
| ||||||||||||||||||||
| A final substrate-level phosphorylation now forms a molecule of pyruvate and a molecule of ATP by means of the enzyme pyruvate kinase. This serves as an additional regulatory step, similar to the phosphoglycerate kinase step.
عوامل مساعدة: Mg2+ |
| ||||||||||||||||||||
التنظيم
تغيرات الطاقة الحرة
| Compound | Concentration / mM |
|---|---|
| glucose | 5.0 |
| glucose-6-phosphate | 0.083 |
| fructose-6-phosphate | 0.014 |
| fructose-1,6-bisphosphate | 0.031 |
| dihydroxyacetone phosphate | 0.14 |
| glyceraldehyde-3-phosphate | 0.019 |
| 1,3-bisphosphoglycerate | 0.001 |
| 2,3-bisphosphoglycerate | 4.0 |
| 3-phosphoglycerate | 0.12 |
| 2-phosphoglycerate | 0.03 |
| phosphoenolpyruvate | 0.023 |
| pyruvate | 0.051 |
| ATP | 1.85 |
| ADP | 0.14 |
| Pi | 1.0 |
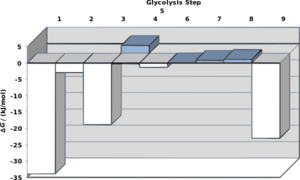 The change in free energy for each step of glycolysis estimated from the concentration of metabolites in an erythrocyte. | |
| Step | Reaction | ΔG°' / (kJ/mol) | ΔG / (kJ/mol) |
|---|---|---|---|
| 1 | glucose + ATP4- → glucose-6-phosphate2- + ADP3- + H+ | -16.7 | -34 |
| 2 | glucose-6-phosphate2- → fructose-6-phosphate2- | 1.67 | -2.9 |
| 3 | fructose-6-phosphate2- + ATP4- → fructose-1,6-bisphosphate4- + ADP3- + H+ | -14.2 | -19 |
| 4 | fructose-1,6-bisphosphate4- → dihydroxyacetone phosphate2- + glyceraldehyde-3-phosphate2- | 23.9 | -0.23 |
| 5 | dihydroxyacetone phosphate2- → glyceraldehyde-3-phosphate2- | 7.56 | 2.4 |
| 6 | glyceraldehyde-3-phosphate2- + Pi2- + NAD+ → 1,3-bisphosphoglycerate4- + NADH + H+ | 6.30 | -1.29 |
| 7 | 1,3-bisphosphoglycerate4- + ADP3- → 3-phosphoglycerate3- + ATP4- | -18.9 | 0.09 |
| 8 | 3-phosphoglycerate3- → 2-phosphoglycerate3- | 4.4 | 0.83 |
| 9 | 2-phosphoglycerate3- → phosphoenolpyruvate3- + H2O | 1.8 | 1.1 |
| 10 | phosphoenolpyruvate3- + ADP3- + H+ → pyruvate- + ATP4- | -31.7 | -23.0 |
منطق الكيمياء الحيوي
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التنظيم
الهكسوناز
الفوسفوفركتوكيناز
كيناز الپيروڤات
من فوائد التحلل السكري
1- تكوين جزيئات الطاقة العالية(ATP;NADH) والتي تعتبر مصدر الطاقة في الخلية.
2- تكوين حمض البيروفيك(Pyruvic acid)والذي يدخل في دورة حمض الستريك لإنتاج الطاقة هوائيا داخل المتقدرات ( Mitochondria ).
3- إنتاج جزيئات أخرى تدخل في عمليات حيوية مختلفة.
يتكون التحلل السكري من مرحلتين: يتم في الأولى منهما استهلاك كمية من الطاقة (جزيئين ATP)لإنتاج جزيئات ذات طاقة أعلى(Glyceraldehyde-3-Phosphate) والتي تتحول فيما بعد إلى جزيئات ذات طاقة اقل(حمض البيروفيك)، لذلك فان تحلل مول واحد من الجلوكوز إلى مولين من حمض البيروفيك يصاحبه إنتاج مولين من ATPو NADH. يستخدم ال NADH كوقود لإنتاج الATP في الميتوكندريا عن طريق الفسفرة التاكسدية، كل جزئ NADH ينتج جزيئين أو ثلاثة ATP والناتج الكلي لعملية الاكسدة لجزئ الجلوكوز هي 36 أو 38 جزئ ATP.
ما بعد عملية التحلل
- glucose + 2 NAD+ + 2 ADP + 2 Pi → 2 pyruvate + 2 NADH + 2 H+ + 2 ATP + 2 H2O
التخمر
- pyruvate + NADH + H+ → lactate + NAD+
التنفس اللاهوائي
التنفس الهوائي
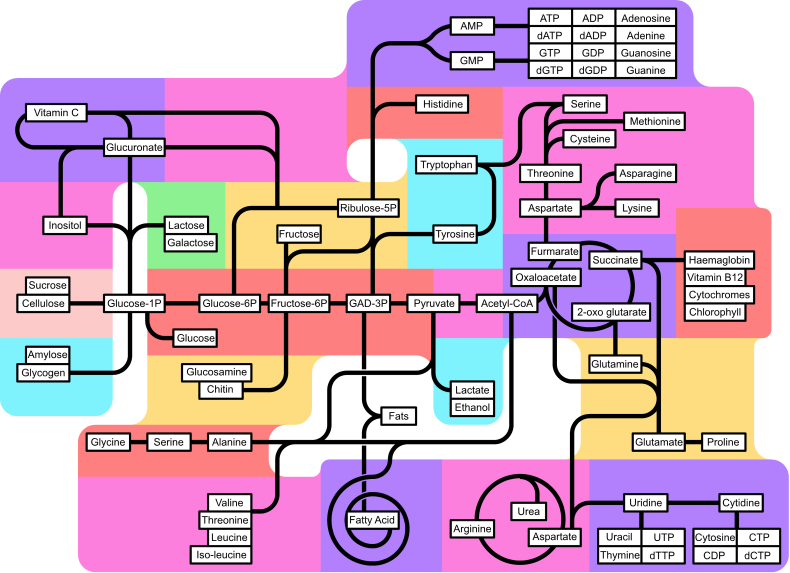
وسائط لمسارات أخرى
تعتمد هذه المسارات الأيضية على عملية تحلل السكر كمصدر للأيضات التالية:
- استحداث السكر
- أيض الدهون
- Pentose phosphate pathway
- دورة حمض الستريك، والتي تؤدي بدورها إلى:
تحلل السكر في الأمراض
الامراض الوراثية
السرطان
مرض ألزهامير
التسميات البديلة
| هذا المقال | الأسماء البديلة | المصطلحات البديلة | ||
|---|---|---|---|---|
| 1 | گلوكوز | Glc | دكستروز | |
| 3 | فوسفات سداسي الفركتوز | F6P | ||
| 4 | fructose 1,6-bisphosphate | F1,6BP | fructose 1,6-diphosphate | FBP, FDP, F1,6DP |
| 5 | dihydroxyacetone phosphate | DHAP | glycerone phosphate | |
| 6 | glyceraldehyde 3-phosphate | GADP | 3-phosphoglyceraldehyde | PGAL, G3P, GALP,GAP,TP |
| 7 | 1,3-bisphosphoglycerate | 1,3BPG | glycerate 1,3-bisphosphate, glycerate 1,3-diphosphate, 1,3-diphosphoglycerate |
PGAP, BPG, DPG |
| 8 | 3-phosphoglycerate | 3PG | glycerate 3-phosphate | PGA, GP |
| 9 | 2-phosphoglycerate | 2PG | glycerate 2-phosphate | |
| 10 | phosphoenolpyruvate | PEP | ||
| 11 | پيروڤات | Pyr | حمض الپيروڤيك | |
انظر أيضا
المصادر
- ^ Webster's New International Dictionary of the English Language, 2nd ed. (1937) Merriam Company, Springfield, Mass.
- ^ أ ب ت Glycolysis - Animation and Notes
- ^ Reeves, R. E. (1974). "Pyrophosphate: D-fructose 6-phosphate 1-phosphotransferase. A new enzyme with the glycolytic function 6-phosphate 1-phosphotransferase". J Biol Chem. 249 (24): 7737–7741. PMID 4372217.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Selig, M. (1997). "Comparative analysis of Embden-Meyerhof and Entner-Doudoroff glycolytic pathways in hyperthermophilic archaea and the bacterium Thermotoga". Arch Microbiol. 167 (4): 217–232. PMID 9075622.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةImportanceBalance - ^ Garrett, R.; Grisham, C. M. (2005). Biochemistry (3rd ed.). Belmont, CA: Thomson Brooks/Cole. p. 584. ISBN 0-534-49011-6.
{{cite book}}: Check|isbn=value: checksum (help) - ^ Garrett, R.; Grisham, C. M. (2005). Biochemistry (3rd ed.). Belmont, CA: Thomson Brooks/Cole. pp. 582–583. ISBN 0-534-49011-6.
{{cite book}}: Check|isbn=value: checksum (help)
وصلات خارجية
- A Detailed Glycolysis Animation provided by IUBMB (Adobe Flash Required)
- The Glycolytic enzymes in Glycolysis at Protein Data Bank
- Glycolytic cycle with animations at wdv.com
- Metabolism, Cellular Respiration and Photosynthesis - The Virtual Library of Biochemistry and Cell Biology at biochemweb.org
- notes on glycolysis at rahulgladwin.com
- The chemical logic behind glycolysis at ufp.pt
- Expasy biochemical pathways poster at ExPASy
- Mnemonic at medicalmnemonics.com 317 5468