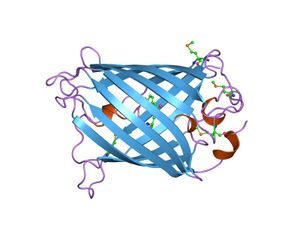
بروتين فلوري أخضر
البروتينات الفلورية الخضراء (بالإنجليزية:Green fluorescent protein) أو اختصارا (GFP) هي بروتينات تتكون من 238 حمض أميني (26.9 kDa) والتي تشع بلون أخضر فلوري عند تعرضها لضوء أزرق اللون. تتواجد هذه المادة في الكثير من الأحياء البحرية وبشكل خاص في قنديل البحر من نوع إيكووريا فكتوريا. للبروتين الفلوري الأخضر المعزول من قنديل البحر إيكووريا فيكتوريا ذروة إصدار عند طول موجة قدره 509 نانومتر، وهو يعادل تقريبا طول موجة الضوء الأخضر في الطيف المرئي. أصبحت البروتينات الفلورية الخضراء من أهم المواد المستخدمة في مجالات العلوم الحيوية الحديثة، حيث تستخدم لمراقبة عمليات نمو الخلايا العصبية في المخ، وكيفية انتشار الخلايا السرطانية.
تاريخ
استخلص البروتين الأخضر المشع ودرست خصائصه للمرة الأولى في ستينات وسبعينات القرن العشرين على يد عالم الأحياء البحرية اوسامو شيمومورا، والذي لاحظ أن هذا الصنف من قناديل البحر يشع بلون أزرق ثم يعطى بعد ذلك توهجاً أخضر اللون، لذا حاول عزل المادة التي ظن أنها ترتبط بتلك الخاصية المميزة في ذلك الحيوان البحري. وقام شيمومورا بجمع عشرات الآلاف من هذا الصنف من قناديل البحر، وقد نجح في عزل تلك المادة في العام 1962، حيث ُأطلق عليها لاحقاً اسم البروتين الأخضر المشع. إلا أنه لم يبدأ بإدراك أهميتها كأداة في علم الأحياء الخلوي حتى عام التسعينات من القرن العشرين. حيث قام مارتن تشالفي بنشر كود البروتين الأخضر المشع في خلايا الإشريكية القولونية والربداء الرشيقة.
حصل القائمون على مجموعة أبحاث تتعلق بالمادة على جائزة نوبل في الكيمياء في عام 2008 وهم، اوسامو شيمومورا، مارتن تشالفي وروجر تسيان.
البنية
البروتين الفلوري الأخضر له بنية برميل بيتا beta barrel نمطية، تتكون من β-sheet واحد مع لولب ألفا (أو أكثر) يحتوي الكروموفور المرتبط تساهمياً 4-(p-hydroxybenzylidene)imidazolidin-5-one (HBI) ماراً بالمركز.[1][2][3] HBI is nonfluorescent in the absence of the properly folded GFP scaffold and exists mainly in the unionized phenol form in wtGFP.[citation needed] Inward-facing sidechains of the barrel induce specific cyclization reactions in the tripeptide Ser65–Tyr66–Gly67 that induce ionization of HBI to the phenolate form and chromophore formation. This process of post-translational modification is referred to as maturation.[citation needed] The hydrogen-bonding network and electron-stacking interactions with these sidechains influence the color, intensity and photostability of GFP and its numerous derivatives.[citation needed] The tightly packed nature of the barrel excludes solvent molecules, protecting the chromophore fluorescence from quenching by water.
|
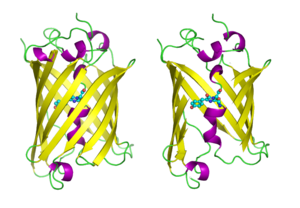 جزيئات البروتين الفلوري الأخضر، مرسومة بأسلوب كرتوني، واحد كامل وواحد يظهر منه جانب برميل بيتا مزالاً ليُظهـِر الكروموفور (موضحاً على شكل ككرة وعصي). من PDB 1GFL. | ||||||||||||||||||||||||||||
الاستخدامات
The availability of GFP and its derivatives has thoroughly redefined fluorescence microscopy and the way it is used in cell biology and other biological disciplines.[5] While most small fluorescent molecules such as FITC (fluorescein isothiocyanate) are strongly phototoxic when used in live cells, fluorescent proteins such as GFP are usually much less harmful when illuminated in living cells. This has triggered the development of highly automated live-cell fluorescence microscopy systems, which can be used to observe cells over time expressing one or more proteins tagged with fluorescent proteins. For example, GFP had been widely used in labelling the spermatozoa of various organisms for identification purposes as in Drosophila melanogaster, where expression of GFP can be used as a marker for a particular characteristic. GFP can also be expressed in different structures enabling morphological distinction. In such cases, the gene for the production of GFP is spliced into the genome of the organism in the region of the DNA that codes for the target proteins and that is controlled by the same regulatory sequence; that is, the gene's regulatory sequence now controls the production of GFP, in addition to the tagged protein(s). In cells where the gene is expressed, and the tagged proteins are produced, GFP is produced at the same time. Thus, only those cells in which the tagged gene is expressed, or the target proteins are produced, will fluoresce when observed under fluorescence microscopy. Analysis of such time lapse movies has redefined the understanding of many biological processes including protein folding, protein transport, and RNA dynamics, which in the past had been studied using fixed (i.e., dead) material.
شعاع ليزر من عيون البشر
بعد يوم ، فإن سيوك-هيون يون و مالطى جاثر هم فيزيائيون في مستشفى ماساتشوستس العام. ولكن في الليل ، وعلى مدى السنوات الأربع الماضية ، هم قد عملوا على جعل الخلايا البشرية تتصرف مثل الليزر. بنوا الليزر البشرى من نفس العناصر الثلاثة الموجودة في جميع أجهزة الليزر : المضخة المصدر ، وهى التي توفر الطاقة الأولية الخفيفة ؛ تجويف بصري ، والتي تركز الضوء من المضخة المصدر لتركيزه في شعاع ، ووسط كسب ، وهي المادة التي يتم فيها إثارة الإلكترونات حتى تصل إلى حالة أعلى من الطاقة ومن ثم يتم إطلاقها في وقت واحد بخد إنتقالها إلى مستوى أعلى من الطاقة كما أن الطاقة من شعاع الليزر هى من الفوتونات الخفيفة.
يون و جاثر عملوا على تعديل خلية الكلى البشرية لانتاج البروتينات الفلورية الخضراء (GFP) ، و هى المادة التي تجعل القناديل تصدر ضوءا بيولوجيا bioluminescent . وكان هذا هو وسط الكسب وقاموا بزراعة هذه الخلايا المعدلة ووضع واحدة بين اثنين من المرايا، و هكذا خلقوا التجويف البصري، على شكل "شطيرة الخلية" ، هكذا قال يون. ثم أرسلوا نبضات من ضوء أزرق من الليزر المصغرة (المضخة المصدر) من خلال خلية، حيث ارتد بين المرايا. وتوهجت الخلية بضوء أخضر، وعلى الفور إنطلق النور. من خلال المجهر، رأى علماء الفيزياء كتلة رمادية (الخلية) مع بقع الانارة (ليزر).
وماذا بعد؟
يمكن استخدام شعاع الليزر النشط لتنشيط أدوية العلاج الضوئي للسرطان .ويمكن للأطباء حقن المركبات الحساسة للضوء في مجرى دم المريض للبحث عن الأورام والخلايا المريضة.
عادة، يتم تنشيط هذه المركبات من الخارج، ولكن إذا كان كل من الأدوية والضوء هم أصلا داخل الخلية فإن العلاج قد يكون أكثر دقة. الآن ، ورغم ذلك ، يون مهتم في المقام الأول بإمكانية استخدام الليزر البشرى للكشف عن تغيرات طفيفة في الخلايا. الضوء المتضارب يمر من خلال الخلايا آلاف أو ملايين المرات , قبل أن ينبثق شعاع الليزر . يقول يون أن العلماء يمكنهم أن يستخدمواالضوء المرتد لرصد سلوك الخلية بحساسية غير مسبوقة, مشابهة لكاميرا عالية السرعة داخل الخلايا. نعم، وكما يقول ، فإنه يمكن لذلك الأسلوب في يوم ما أن يتيح للناس تبادل إطلاق أشعةالليزر من أعينهم , على الرغم من أن يمكن أن يكون أكثر إضاءة من أشعة الموت . “إذا كان مصدر الضوء مزروعا داخل العين , قد يكون من الممكن السيطرة عليه بإشارات من الدماغ. "[6]
اقرأ أيضاً
الهامش
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةTsien_1998 - ^ Ormö M, Cubitt A, Kallio K, Gross L, Tsien R, Remington S (1996). "Crystal structure of the Aequorea victoria green fluorescent protein". Science. 273 (5280): 1392–5. doi:10.1126/science.273.5280.1392. PMID 8703075.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Yang F, Moss L, Phillips G (1996). "The molecular structure of green fluorescent protein". Nat Biotechnol. 14 (10): 1246–51. doi:10.1038/nbt1096-1246. PMID 9631087.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Ormö M, Cubitt AB, Kallio K, Gross LA, Tsien RY, Remington SJ (1996). "Crystal structure of the Aequorea victoria green fluorescent protein". Science. 273 (5280): 1392–5. doi:10.1126/science.273.5280.1392. PMID 8703075.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Yuste R (2005). "Fluorescence microscopy today". Nat Methods. 2 (12): 902–4. doi:10.1038/nmeth1205-902. PMID 16299474.
- ^ Becky Ferreira (2011-12-26). "Will We Soon Be Able to Fire Laser Beams From Our Eyes?". پوپيولار ساينس.
مصادر
وصلات خارجية
- Video: Roger Tsien Gives Nobel Lecture at UC San Diego
- A comprehensive article on fluorescent proteins at Scholarpedia
- Introduction to fluorescent proteins
- History, uses, and structure of GFP
- Brief summary of landmark GFP papers
- Interactive Java applet demonstrating the chemistry behind the formation of the GFP chromophore
- Tsien Lab @ UCSD
- Video of 2008 Nobel Prize lecture of Roger Tsien on fluorescent proteins
- Excitation and emission spectra for various fluorescent proteins
- Timeline
- Some factoids about Aequorea, the jellyfish source of GFP
- Video introduction to GFP, from the "Secrets of the Sequence" educational video series
- Green Fluorescent Protein Chem Soc Rev themed issue dedicated to the 2008 Nobel Prize winners in Chemistry, Professors Osamu Shimomura, Martin Chalfie and Roger Y. Tsien