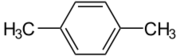
پ-زايلين
 | |
 نموذج ملء الفراغ.
| |
| الأسماء | |
|---|---|
| اسم أيوپاك المفضل
1,4-Xylene | |
| اسم أيوپاك النظامي
1,4-Dimethylbenzene | |
| أسماء أخرى
p-Xylene, 1,4-dimethylbenzene, p-dimethylbenzene; p-xylol; 1,4-xylene; p-methyltoluene; paraxylene; chromar; scintillar; 4-methyltoluene; NSC 72419; or 1,4-dimethylbenzene.[1]
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.003.088 |
| KEGG | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | C8H10 |
| كتلة مولية | 106.17 g mol-1 |
| المظهر | Colorless liquid |
| الرائحة | Aromatic[2] |
| الكثافة | 0.861 g/mL |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | غير قابل للذوبان |
| قابلية الذوبان في الإيثانول | شديد الذوبان |
| قابلية الذوبان في إثير ثنائي الإيثيل | شديد الذوبان |
| ضغط البخار | 9 mmHg (20°C)[2] |
| القابلية المغناطيسية | -76.78·10−6 سم3/مول |
| معامل الانكسار (nD) | 1.49582 |
| اللزوجة | 0.7385 cپ عند 0 °س 0.6475 سپ عند 20 °س |
| Dipole moment | 0.00 د [3] |
| المخاطر | |
| خطر رئيسي | ضار أو قاتل عند بلغه. سائل وبخار سام، قابل للاشتعال. |
| صفحة بيانات السلامة | External MSDS |
| توصيف المخاطر | R10 R20 R21 R36 R38 |
| تحذيرات وقائية | قالب:S25 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | 27 °C (81 °F; 300 K) [4] |
| 528 °C (982 °F; 801 K)[4] | |
| حدود الانفجار | 1.1%-7.0%[2] |
| 100 ppm[4] (TWA), 150 ppm[4] (STEL) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LC50 (التركيز الأوسط)
|
4550 ppm (rat, 4 hr)[5] |
LCLo (المنشورة الأقل)
|
3401 ppm (mouse)[5] |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 100 ppm (435 mg/m3)[2] |
REL (الموصى به)
|
TWA 100 ppm (435 mg/m3) ST 150 ppm (655 mg/m3)[2] |
IDLH (خطر عاجل)
|
900 ppm[2] |
| مركبات ذا علاقة | |
هيدروكربونات
عطرية ذات العلاقة |
بنزين تولوين أ-زايلين م-زايلين |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
پ-زايلين (پارا-زايلين)، هو هيدروكربون عطري. وهو واحدة من الأيزومرات الثلاثة للبنزين ثنائي الميثيل الشهيرة بالزايلينات. حرف "پ" يشير إلى "پارا"، أي مجموعتين الميثيل الموجودة في "پ"-زايلين والتي تحتل مواقع المستبدلين المقابلين للمواقع 1 و4. ويوجد في مواقع مجموعتين الميثيل، نمط الاستبدال في الحلقات العطرية، الذي يميزه عن الأيزومرات الأخرى، أ-زيلين وم-زايلين. وتمتلك جميعها نفس الصيغة الكيميائية C6H4(CH3)2. جميع أيزومرات الزايلين عديمة اللون وشديدة الإشتعال.[6]
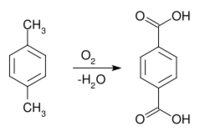
الپارا-زايلين مادة أولية أساسية تستخدم لإنتاج حمض الترفتاليك النقي، وهو عنصر كيميائي مهم يستخدم في تصنيع ألياف الپوليستر، وراتنجات ترفتالات الپوليإثيلين المستخدمة على نطاق واسع في صناعة مواد التغليف والتعبئة وقوارير تعبئة المشروبات.
الإنتاج
يعتبر إنتاج پارا-زيلين كبيراً من الناحية الصناعية، حيث يُقدر الطلب السنوي بـ37 مليون طن في عام 2014، ولا يزال حتى الآن في ازدياد.[7][8] بارا-زيلين يتم إنتاجه عن طريق إصلاح الحفاز النفاث النفطي كجزء من عطريات بتكس (البنزين والتولوين وأيزومرات الزيلين) المستخرجة من الإصلاح الحفاز. ثم يتم فصل الزيلين في سلسلة من عمليات التقطير أو الامتصاص أو التبلور ورد الفعل من ميتا-زيلين، أورثو-زيلين، وإيثيل بنزين. ونقطة انصهاره هي الأعلى بين هذه السلسلة من الأيزومرات، ولكن التبلور البسيط لا يسمح بالتنقية السهلة بسبب تكوين مخاليط يوتكتيك.
إن إجراءات الفصل هي عوامل التكلفة الرئيسية في إنتاج الزيلين، وما زال البحث مستمراً عن طرق بديلة. وعلى سبيل المثال، تم اقتراح تقنية التناضح العكسي لتحسين جوانب مختلفة من العمليات.
التطبيقات الصناعية
يُعتبر پارا-زيلين مادة خام كيميائية هامة. من بين التطبيقات الصناعية الأخرى، يُعتبر مادة خام في التوليف على نطاق واسع من الپوليمرات المختلفة. على وجه الخصوص فهو عنصر في إنتاج حمض التريفتاليك للپوليستر مثل الپولي إثيلين تيريفثالات. ويمكن أيضا بلمرته مباشرةً لإنتاج پاريلين.
السمية والتعرض
لا يُعتبر مادة سامة للغاية، الآثار تختلف مع نُظرائه في المتزامرات. المخاوف مع زيلينس ترتكز على الآثار المخدرة. التعرض المفرط لبارا-زيلين في البشر يمكن أن يسبب الصداع، والتعب، والدوخة، والخمول، والارتباك، والتهيج، واضطرابات الجهاز الهضمي بما في ذلك الغثيان وفقدان الشهية، والتقيؤ، والشعور بزيادة حرارة الجسم. والتعرض لبخاره يمكن أن يسبب تهيج في العين والأنف والحلق والصدر.
پارا-زيلين يحدث بشكل طبيعي في البترول وقطران الفحم. وتنبعث منه معظم مصادر الاحتراق، بما في ذلك عوادم السيارات ودخان التبغ.
الاستنشاق
استنشاق پارا-زيلين يمكن أن يسبب الدوخة، والصداع، والنعاس، والغثيان. في حالة حدوث التعرض من خلال الاستنشاق، تشمل الإسعافات الأولية الهواء النقي والراحة والعناية الطبية المحتملة. من خلال استخدام التهوية أو حماية التنفس.
الجلد
التعرض له من خلال الجلد يمكن أن يسبب جفاف الجلد واحمراره. في حالة حدوث تعرض الجلد، تشمل الإسعافات الأولية تنظيف ثم غسل المنطقة المصابة بالماء والصابون، وكذلك إزالة أي ملابس ملوثة وتنظيفها وتجفيفها جيدا قبل إعادة استخدامها. يمكن الوقاية من التعرض من خلال استخدام القفازات الواقية.
العيون
عند تعرضه للعيون يمكن أن يسبب احمرار وألم. إذا تعرضت العينين، تشمل الإسعافات الأولية شطف العينين بالماء لعدة دقائق، وإزالة العدسات اللاصقة إن وجدت، والاهتمام الطبي. يمكن منع التعرض للعيون من خلال استخدام نظارات السلامة.
الابتلاع
ابتلاع بارا-زيلين يمكن أن يؤدي إلى حرقان وآلام في البطن، والدوخة، والنعاس، والصداع، والغثيان. إذا تم تناولها.
المصادر
- ^ "p-xylene". NIST. Retrieved 21 February 2013.
- ^ أ ب ت ث ج ح NIOSH Pocket Guide to Chemical Hazards 0670
- ^ Perry's Handbook of Chemical Engineers
- ^ أ ب ت ث "p-Xylene". International Chemical Safety Cards. ICSC/NIOSH. July 1, 2014.
- ^ أ ب "Xylenes". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "p-Xylene MSDS". ScienceLab.com.
{{cite web}}:|access-date=requires|url=(help); Missing or empty|url=(help) - ^ Fabri, Jörg; Graeser, Ulrich, and Simo, Thomas A., Xylenes, Ullmann's Encyclopedia of Industrial Chemistry, 2000, Wiley-VCH, Weinheim. Accessed 2015-2-8 DOI:10.1002/14356007.a28_433. Archived 2017-08-06 at the Wayback Machine
- ^ Nature 532,435–437 (28 April 2016) doi:10.1038/532435a
وصلا خارجية
- CS1 errors: requires URL
- CS1 errors: access-date without URL
- Articles with changed EBI identifier
- Articles with changed ChemSpider identifier
- ECHA InfoCard ID from Wikidata
- Articles with changed FDA identifier
- Articles with changed InChI identifier
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- ألكيلات البنزين
- مسرطنات المجموعة 3 حسب تصنيف الوكالة الدولية لأبحاث السرطان