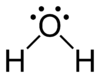
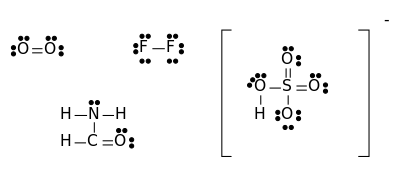
بنية لويس
بنية لويس Lewis structure (وتعرف أيضاً بأي من الأسماء التالية ترتيب لويس، مخطط لويس النقطي ، المخطط النقطي للإلكترونات أو البنى النقطية للإلكترونات) هي مخططات تُظهر الترابط بين ذرات جزيء والأزواح الوحيدة من الإلكترونات التي قد تتواجد في الجزيء.[1][2][3] يتم الترتيب بنقاط من 1 إلى ثمانية نقاط ويتم من الاغلفة الخارجية وبطريقة الجمع.
يستخدم مبدأيا لإظهار المواقع النسبية لمختلف الذرات بالنسبة لبعضها وتشكيلات الروابط التكافؤية التي تجمع بين مختلف ذرات المركب إضافة إلى توضع الإلكترونات بالنسبة لذرات الجزيء. يمكن رسم بنية لويس لأي جزيء يحوي رابطة تساهمية بالإضافة إلى المعقدات.
التسمية
تنسب التسمية إلى العالم گلبرت لويس، الذي قام بتقديمها في مقالته الذرة والجزيء التي تعود إلى عام 1916 [4]. تشبه بنية لويس المخططات النقطية للإلكترونات من حيث أن الإلكترونات التكافؤية تمثل بنقط عندما تكون منفردة وغير متزاوجة، ولكن عندما تكون الإلكترونات مشتركة في الرابطة التساهمية تمثل في بنية لويس على شكل خط متصل.
الإنشاء
عد الإلكترونات
 مقالة مفصلة: عد الإلكترونات
مقالة مفصلة: عد الإلكترونات
موضعة الإلكترونات
LewisStr
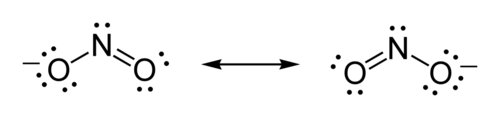
مثال: بنية لويس لأيون النيتريت
صيغة أيون النيتريت هي NO2−.
الشحنة الشكلية
 مقالة مفصلة: الشحنة الشكلية
مقالة مفصلة: الشحنة الشكلية
حيث:
- is the Formal charge.
- represents the number of valence electrons in a free atom of the element.
- represents the number of unshared electrons on the atom.
- represents the total number of bonds the atom has with another.
الرنين
 مقالة مفصلة: بنية الرنين
مقالة مفصلة: بنية الرنين
الصيغ البديلة
انظر أيضاً
- Valence shell electron pair repulsion theory
- Molecular geometry
- Structural formula
- Natural bond orbital
الهامش
- ^ IUPAC definition of Lewis formula
- ^ Zumdahl, S. (2005) Chemical Principles Houghton-Mifflin (ISBN 0-618-37206-7)
- ^ Miessler, G. L., Tar, D. A., (2003) "Inorganic Chemistry" 2nd ed. Pearson Prentice-Hall (ISBN 0-130-35471-6)
- ^ Lewis, G. N. The Atom and the Molecule. J. Am. Chem. Soc. 1916, 38, 762-785. |10.1021/ja02261a002