ياكوبوس هنريكوس ڤانت هوف
ياكوبوس هنريكوس ڤانت هوف Jacobus Henricus van 't Hoff | |
|---|---|
 ياكوبوس هنريكوس ڤانت هوف | |
| وُلِدَ | 30 أغسطس 1852 روتردام، هولندا |
| توفي | 1 مارس 1911 (aged 58) شتگلتس، برلين، ألمانيا |
| الجنسية | هولندا |
| المدرسة الأم | معهد پوليتكنيك دلفت جامعة ليدن جامعة بون جامعة باريس جامعة اوترخت |
| اللقب | الحركة الكيميائية، الكيمياء الفراغية |
| الجوائز | جائزة نوبل في الكيمياء (1901) |
| السيرة العلمية | |
| المجالات | كيمياء فيزيائية كيمياء عضوية |
| الهيئات | الكلية البيطرية في اوترخت جامعة أمستردام جامعة برلين |
| المشرف على الدكتوراه | إدوارد ملدر |
| طلاب الدكتوراه | إدگار برايت ولسون |
ياكوبوس هنريكوس ڤانت هوف (Jacobus Henricus van 't Hoff) (و. 30 أغسطس 1852 - ت. 1 مارس 1911)، هو كيميائي هولندي تخصص في الكيمياء العضوية والكيمياء الفيزيائية. حصل على جائزة نوبل في الكيمياء لعام 1901 “اعترافاً بخدماته الهائلة المتمثلة في اكتشافه قوانين الديناميكا الكيميائية والضغط الاوزموزي في المحاليل.” وفي الكيمياء الفراغية في 1874، تعرف على أن الروابط الكيميائية الأربعة للكربون لها ترتيب رباعي الأوجه، وهو ما شرح كيف أن بعض الجزيئيات يمكن ترتيبهم بأشكال مختلفة بنفس الذرات ليعطوا متماكبات isomers اليد اليسرى واليد اليمنى. (وقد توصل آشي بل Achille Bel بشكل مستقل إلى نفس الاستنتاج تقريباً في نفس الوقت.) وفيما يتعلق بالضغط الاوزموزي للسوائل، فقد اشتق قوانين (1886) للمحاليل المخففة مماثل لقوانين الغازات التي توصل إليها روبرت بويل وجوزيف گاي-لوساك. وقد مكـَّنت تلك العلاقات من التحديد التجريبي للوزن الجزيئي لمادة في محلول.«
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
السيرة الذاتية
وُلِدَ في روتردام بهولندا، درس الكيمياء في دلفت Delft ثم انتقل إلى جامعة لايدن عام 1871، وفي السنة التالية انتقل إلى جامعة بون في ألمانيا ودرس فيها مدة قصيرة ثم انتقل إلى باريس حيث عمل في كلية الطب بمختبر ڤورتس A.Wurtz. وفي عام 1874 حصل على الدكتوراه من جامعة اوترخت، وبعد سنتين عمل مدرساً في كلية محلية للبيطرة. وفي عام 1878 أصبح أستاذاً للكيمياء وعلم التعدين والجيولوجيا في جامعة أمستردام وبقي فيها حتى عام 1896، إذ انتخب للعمل في أكاديمية العلوم الپروسية في برلين، وقَبِلَ منصب أستاذ فخري في جامعة برلين وبقي يعمل هناك حتى وفاته.
الإنجازات العلمية
كانت طريقة ارتباط الكربون مع الذرات الأخرى في المركبات العضوية لغزاً حيَّر الكيميائيين. وفي عام 1858 وجد كيكوليه Kekulé حلاً لتفسير ذلك اللغز، وهو أن الكربون «عنصر رباعي»؛ أي إن له أربع «وحدات ألفة»، ويُقصد بذلك أربع روابط يستطيع أن يرتبط بها مع أربعة عناصر أحادية التكافؤ كالهدروجين أو مع عنصرين ثنائيي التكافؤ كالأكسجين. والخطوة الأهم في أعمال كيكوليه هي معرفة أن ذرة الكربون يمكنها بإحدى «وحداتها» أن تتحد مع ذرة كربون أخرى ويبقى لكل من ذرتي الكربون ثلاث «وحدات» للارتباط بذرات أخرى.
اكتشف الكيميائيون في النصف الثاني من القرن التاسع عشر أن هناك تماكباً (تماثلاً في التركيب) isomerism ذا أهمية كبيرة في الكيمياء الحيوية. مثال ذلك السكاكر التي توجد في متماكبين، ولا يستفيد جسم الإنسان إلا من أحدهما فقط. وأحد المتماكبين يحرف الضوء المستقطِب إلى اليمين في حين يحرف المماكب الآخر الضوء المستقطب نحو اليسار. وهناك بعض المواد، مثل سبار آيسلندا Iceland spar البلوري الشفاف ينكسر فيه الضوء وينفذ منه مستقطباً. وتتضح الاهتزازات الحادثة بصورة تخطيطية في الضوء المستقطب في واحد فقط من المستويات الممكنة. فكأن صفيف الذرات في البلورة يسمح لمستويات معينة فقط بالعبور.
اكتشف الفيزيائي الفرنسي باتيست بيو Jean- Baptise Biot عام 1815 أن بلورات الكوارتز (وهو سيليس بلوري) تحرف مستوى الضوء المستقطب. وتوصف أمثال هذه البلورات أنها فعّالة ضوئياً. وبعض بلورات الكوارتز تحرف الضوء المستقطب نحو اليمين dextrorotation في حين أن بعضها الآخر يحرف الضوء المستقطب نحو اليسار levorotation. وقد وجد بيو أن بعض المركبات العضوية كالكافور، وحمض الطرطير تسلك السلوك نفسه. فخمّن بيو أن سبب حَرْف الضوء المستقطب يعود إلى نوع من عدم التناظر في ترتيب الذرات في جزيئات هذه المواد.
وبعد عقود عدة من اكتشاف بيو؛ وجد لويس پاستور Pasteur عام 1844 أن حمض الطرطير الراسيمي (وهو مزيج نصف جزيئاته من حمض الطرطير اليميني ونصفه الآخر من حمض الطرطير اليساري) له التركيب الكيمياوي لحمض الطرطير نفسه، إلا أنه لا يحرف الضوء المستقطب. فحص باستور بلورات من ملح لحمض الطرطير الراسيمي في المجهر فوجد - على غير المتوقع - نوعين من البلورات، وكان كلاهما غير متناظر. فنصف البلورات له هيئة ملح حمض الطرطير (يميني التدوير) بينما نصفها الآخر له هيئة خيال الأولى في المرآة (أي مثل كف اليد اليمنى وكف اليد اليسرى) وأن نصف البلورات الراسيمي يحرف الضوء المستقطب يميناً والنصف الآخر يحرفه يساراً بالمقدار نفسه، ولهذا يكون المحلول الراسيمي غير فعال ضوئياً.
ثم اكتشفت مواد أخرى لها الخواص الضوئية لحمض الطرطير نفسها ولكن موضوع عدم التناظر بقي لغزاً محيراً.
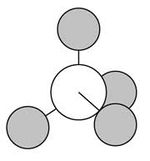
أهم عمل أنجزه ڤانت هوف عام 1874 أي بعد وفاة بيو باثنتي عشرة سنة والفرنسي جوزيف-آشي لوبل Joseph-Achille Le Bel، مستقلين، نظرية جديدة تتعلق بالروابط التي يشكلها الكربون، وعلى ضوئها يمكن تفسير بنيات الجزيئات وبنيات خيالها في المرآة.
كانت الروابط الأربع في بنيات كيكوليه جميعها تقع في مستو واحد. أما حسب النظرية الجديدة يمكن تخيل ذرة الكربون مستندة إلى ثلاث قوائم (هي الروابط الثلاث)، أما الرابطة الرابعة فتتجه باتجاه معامد نحو الأعلى. وهذا يعني أن الروابط الأربع تتجه نحو رؤوسِ رباعيِّ وجوهٍ منتظم.
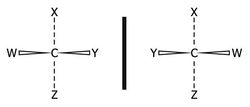
وقد اكتشف ڤانت هوف ولوبِل أن المواد الفعالة ضوئياً (الجزيئات وخيالها في المرآة) التي تحرف الضوء باتجاهين متعاكسين تكون في تركيبها ذرة الكربون مرتبطة بأربع ذرات أو أربع زمر ذرية مختلفة، فالجزيء CXYWZ له ترتيبان لا يمكن انطباق أحدهما على الآخر وأحدهما هو خيال الآخر بالمرآة.
فأحد الترتيبين يحرف الضوء المستقطب يميناً والآخر (خياله في المرآة) يساراً. أما مزيجهما (50% من كل منهما) فهو المزيج الراسيمي الذي لا يحرف الضوء، لأن الانحراف نحو اليمين يفنيه ويعاكسه الانحراف المساوي نحو اليسار.
أكدّت التجارب اللاحقة صحة نظرية لوبل وڤانت هوف، وبحلول عام 1885 أصبحت هذه النظرية مقبولة عالمياً. وكانت هذه النظرية الأساس الذي بُني عليه علم الكيمياء الفراغية Stereochemistry.
نشر ڤانت هوف عام 1884 «دراسات في التحريك الكيمياوي» Studies in Chemical Dynamics وشرح فيها نظرية المحاليل، والتحريك الحراري (الترموديناميك)، والألفة affinity الكيمياوية، ودرس القوانين الناظمة للتوازن الكيمياوي مما ساعد على الاستفادة من التوضعات الملحية في بلاده (في ستاسفورت). وقد بيَّن أيضاً أن هناك علاقة ترموديناميكية بسيطة تربط بين الضغط الحلولي للمحاليل وضغط بخارها. وقد كان أول من طبّق الترموديناميك بصورة منهجية على المحاليل، وقد أسهمت أفكاره إسهاماً كبيراً في تطوير الكيمياء الحديثة.
لهذا كله، أطلق عليه، بحق، اسم «أبو الكيمياء الفيزيائية». حاز جائزة نوبل للكيمياء عام 1901، فكان أول كيميائي يحظى بهذه الجائزة. وتوفي في برلين بألمانيا.[1]
انظر أيضاً
المصادر
- E. W. Meijer (2001). "Jacobus Henricus van 't Hoff; Hundred Years of Impact on Stereochemistry in the Netherlands". Angewandte Chemie International Edition. vol. 40 (no. 20): 3783. doi:10.1002/1521-3773(20011015)40:20<3783::AID-ANIE3783>3.0.CO;2-J.
{{cite journal}}:|issue=has extra text (help);|volume=has extra text (help) - Trienke M. van der Spek (2006). "Selling a Theory: The Role of Molecular Models in J. H. van 't Hoff's Stereochemistry Theory". Annals of Science. vol. 63 (no. 2): 157. doi:10.1080/00033790500480816.
{{cite journal}}:|issue=has extra text (help);|volume=has extra text (help) - Kreuzfeld HJ, Hateley MJ. (1999). "125 years of enantiomers: back to the roots Jacobus Henricus van 't Hoff 1852-1911". Enantiomer. vol. 4 (no. 6): pp. 491–6.
{{cite journal}}:|issue=has extra text (help);|pages=has extra text (help);|volume=has extra text (help)
- ^ هيام بيرقدار. "فانت هوف (ياكوبوس هنريكوس -)(2581-1191)". الموسوعة العربية.
للاستزادة
- Patrick Coffey, Cathedrals of Science: The Personalities and Rivalries That Made Modern Chemistry, Oxford University Press, 2008. ISBN 978-0-19-532134-0
وصلات خارجية
 Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية (eleventh ed.). Cambridge University Press.
Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية (eleventh ed.). Cambridge University Press. {{cite encyclopedia}}: Cite has empty unknown parameter:|coauthors=(help)- قالب:Wikisource author-inline
- Nobel Lecture Osmotic Pressure and Chemical Equilibrium from Nobelprize.org website
- Karl Grandin, ed. "Jacobus Henricus van 't Hoff Biography". Les Prix Nobel. The Nobel Foundation. Retrieved 2008-08-15.
{{cite web}}:|author=has generic name (help)
- Pages using infobox scientist with unknown parameters
- CS1 errors: extra text: volume
- CS1 errors: extra text: issue
- CS1 errors: extra text: pages
- مقالات المعرفة المحتوية على معلومات من دائرة المعارف البريطانية طبعة 1911
- CS1 errors: generic name
- ياكوبوس هنريكوس ڤانت هوف
- مواليد 1852
- وفيات 1911
- فيزيائيون هولنديون
- كيميائيون هولنديون
- حائزو جائزة نوبل في الكيمياء
- طاقم تدريس جامعة هومبولت في برلين
- حائزو جائزة نوبل هولنديون
- علماء كيمياء فيزيائية
- خريجو جامعة لايدن
- أشخاص من روتردام
- طاقم تدريس جامعة أمستردام
- خريجو جامعة بون
- خريجو جامعة أوترخت
- طاقم تدريس جامعة أوترخت
- وفيات بالسل
- أعضاء أجانب في الجمعية الملكية
- خريجو جامعة دلفت للتكنولوجيا