معدن
المعدن (Mineral) هو مركب طبيعي يتكون خلال عمليات جيولوجية. ولا تعود الكلمة على المركب الكيميائي فقط، ولكن على البناء المعدني أيضا. تتغاير المعادن في التركيب من عناصر نقية، وأملاح بسيطة، إلى سليكات غاية في التعقيد بآلاف التكوينات المعروفة. والعلم الذي يدرس المعادن يسمي علم المعادن.
يمكن تعريف المعدن (Mineral) بأنه عبارة عن مادة صلبة وغير عضوية توجد في الأرض بصورة طبيعية , ذات تركيب كيميائي مميز أو متغير في نطاق محدود وله تركيب بلوري داخلي ثابت ويظهر أحياناً على شكل بلورات ويوجد على شكل متبلور في أغلب الأحيان. ويلاحظ من التعريف السابق أن المعدن هو مادة توجد في الطبيعة وليس للإنسان أو الحيوان أو النبات دخل في تكوينها. كما نلاحظ أن التركيب الكيميائي ليس كافياً لتحديد المعدن حيث أنه لا بد أن نعرف التركيب البلوري الذي يتحكم في كثير من الصفات الطبيعية للمعدن مثل الصلابة والمخدش والوزن النوعي واللون. وتوجد المادة الكيميائية على صورة معدن أو أكثر يختلف كل منهما تمام الإختلاف عن الآخر فمثلاً يوجد الكربون في الطبيعة على صورة معدن الألماس وهو أصلب المعادن المعروفة كما يوجد على صورة معدن الجرافيت وهو من أقل المعادن صلابة. وقد تمكن العلماء حتى الآن من وصف أكثر من ألفين معدن مختلف إلا أن جميع المعادن الشائعة التي تدخل في تركيب الصخور وكذلك المعادن الاقتصادية لا تتجاوز مئتي معدن فقط.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التعريف
المعدن مادة صلبة، متجانسة، تحدث طبيعيا، متبلورة,غير عضوية عامة, ولها بناء بلوري وتركيب كيميائي معروف. وفي عام 1995 وضعت منظمة المعادن العالمية تعريفاً أخراً يقول أن: المعدن هو عبارة عن عنصر أو مركب كيميائي بلوري بطبيعته متكون كناتج عمليات جيولوجية. مثل الكالسيت, والماسات المستخرجة من مناجم الماس في إفريقيا. والمعادن تكون متجانسة, ولا يمكن تقسيمها بالطرق الميكانيكية إلى مكونات أصغر. ومعظم المعادن بالتحليل نجد أنها تتكون جميعأً من عناصر كيمائية متحدة مع بعضها البعض وتختلف في نسبها من معدن إلى آخر.
تتميز المعادن metals من اللامعادن عادة بخواص يمكن تقسيمها إلى نوعين: فيزيائية وكيمياوية.
من الوجهة الفيزيائية تتميز المعادن من اللامعادن عامة بكونها صلبة في الدرجة العادية من الحرارة، وبمتانتها وقابليتها للطرق والسحب وبالبريق المعدني وبدرجات انصهار ودرجات غليان عالية، كما تتميز بوزن نوعي مرتفع وناقلية جيدة للحرارة والكهرباء. أما من الوجهة الكيميائية، فالمعادن تشكل أكاسيد أساسية، وتذوب عادة في الحموض مطلقة الهدروجين. وبتعبير آخر تتميز المعادن بكهرجابية عالية فتعطي عند تحليل أملاحها تحليلاً كهربائياً أيونات ions بسيطة موجبة تنطلق على الكاثود (المهبط). وهي لا تشكل مع الهيدروجين، بعكس اللامعادن، مركبات ثابتة وطيارة. أما اللامعادن فتشكل أكاسيد حمضية وتتحول إلى أيونات بسيطة سالبة تنطلق على الأنود (المصعد) لدى تحليل مركباتها تحليلاً كهربائياً.
وتكوِّن المعادن ثلاثة أرباع العناصر في الجدول الدوري. وتقع المعادن النموذجية في القسم الأيسر والسفلي منه. وهناك خاصتان رئيسيتان تميزان العناصر المعدنية جميعها: أولاهما انخفاض طاقة التأين للذرة الحرة في المعدن، وهذه الطاقة هي الطاقة اللازمة لإزاحة أضعف الإلكترونات ارتباطاً في الذرة وهي بالحالة الغازية وتحويلها إلى أيون موجب بالحالة الغازية. وبصورة عامة لا تزيد طاقة التأين على 919.6 كيلوجول/مول. ويشذ عن ذلك الزئبق الذي تبلغ طاقة تأينه 1003.2 كيلوجول/مول. أما الخاصة الثانية التي تميز الذرة المعدنية فهي أن عدد إلكتروناتها التكافؤية أقل من عدد مداراتها التكافؤية.
إن انخفاض طاقة التأين يعني أن للذرة قوة جذب ضعيفة للإلكترونات التكافؤية وإلفتها لإلكترونات أخرى ضعيفة جداً.
تتفق الرابطة المعدنية مع الرابطة المشتركة المميزة لللامعادن من حيث الطبيعة، إذ إن كلاً من الرابطتين يتولد من اشتراك الذرات فيما بينها بإلكترونات التكافؤ. إلا أن الرابطة المشتركة رابطة متموضعة تنشأ فقط بين ذرتين متجاورتين وتبقى الإلكترونات المشتركة في جوارهما المباشر، مرتبطة بهما ارتباطاً متيناً. أما في حالة الرابطة المعدنية، فإن ذرات كتلة المعدن تضع إلكتروناتها التكافؤية مشاعاً فيما بينها؛ لذا فإن الرابطة المشتركة بين ذرات الجسم الصلب لا تسمح بانزلاق الذرات حول بعضها من دون تفكك الرابطة وتخرّب بنيان هذا الجسم، في حين أن هذا الانزلاق ممكن في حالة الرابطة المعدنية من دون تفكك الرابطة. وهذا ما يفسر كون البلورات الملحية واللامعادن الصلبة ذات الروابط المشتركة هشة تقبل الكسر بعكس المعادن التي تتصف بلدونة كبيرة بفضل الرابطة المعدنية.
تُقاس قوة الرابطة المعدنية بحرارة التصعّد وهي الطاقة التي يجب صرفها لفصل المعدن الصلب إلى ذرات معزولة، عندما يصبح بخاراً. وتبلغ هذه الطاقة قيماً كبيرة، خاصة في حالة المعادن الثقيلة، مما يدل على كبر قوة الرابطة واستقرار المعادن وهي في الحالة الصلبة أو السائلة.
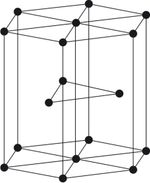
إن تكوّن المعدن من أيونات موجبة تتخلّلها إلكترونات حرة يتفق مع أشكال نماذج الشبكات البلورية التي يمكن تعيينها بوساطة أشعة إكس X-rays. فبخلاف الأملاح التي تتناوب في عقد شبكاتها البلورية الأيونات الموجبة والسالبة؛ فإن الشبكات البلورية للمعادن تتكون من الأيونات الموجبة التي تتماسك بفضل الغاز الإلكتروني. وبما أن الإلكترونات لا تشغل مكاناً يُذكر بسبب ضآلة أبعادها، فإن الأيونات المعدنية تتوزع وفق بنيان يكون فيه تراصها أعظم ما يمكن في معظم الحالات. وإذا عُدّت هذه الأيونات كرات أنصاف أقطارها متساوية فإنه يوجد نموذجان من البنيان البلوري يكون فيه تراص الكرات أعظم ما يمكن، تتوزع الكرات في أحدهما وفق رؤوس مكعب ومراكز وجوهه. ويُسمّى هذا النمط بالنمط المكعبي المركزي الوجوه.
أما في النمط الثاني فإن الكرات تتوزع وفق موشور قاعدته مسدس تقع الكرات في رؤوسه ومركزي قاعدتيه ومراكز ثلاثة من وجوهه.
إلا أن هناك كثيراً من المعادن التي تتبلور وفق نمط بلوري لا يكون فيه التراصّ أعظمياً. فالصوديوم والبوتاسيوم، والفاناديوم على سـبيل المثال، ذات بلـورات تتـوزع فيها الـذرات وفق رؤوس مكعبات ومراكزها. ويُسمّى نمطها البلوري النمط المكعبي المركزي .
التطورات الحديثة
الصخور والخامات، والأحجار الكريمة
أقسام المعادن
المعادن تنقسم إلى معادن فلزية و معادن لافلزية (أو مواد أرضية مثل الفحم, والصلصال, والبترول).
المعادن الفلزية
مثل الذهب والنحاس والحديد والنيكل فهي ذات ألوان طبيعية ثابتة, كما أن لها بريقاً معدنياً, ولها شكل خاص , فهي إما كلوية الشكل مثل بعض معادن الحديد, أو شجرية مثل معادن المنجنيز. وتتميز المعادن الفلزية أيضاً بأنها ذات صفات خاصة من حيث الصلادة, فالمعدن الصلد يمكن أن يخدش ما هو أقل منه صلادة.
المعادن اللافلزية
فتختلف عن الفلزات في أنها تستخدم وهي على صورتها التي تستخرج بها من الطبيعة, فالصلصال مثلأً يستخدمه الإنسان لخواصه الطبيعية وليس لإحتوائه على الألومنيوم, كما أن الأسبستوس (الصخر الحريري) يستخدمه الإنسان لبريقه الحريري ,و لشكله الليفي, ولا للحصول على الماغنسيوم الداخل في تكوينه.
فالمعادن اللافلزية تستخدم في الحقيقة لما لها من خصائص ومميزات طبيعية وليس لخصائصها الكيمائية.
معادن أولية
ويقصد بها تلك المعادن التي تكونت أول ما تكونت أثناء فترة تكوين المعادن في فجر حياة الكرة الأرضية، وقد كان تكوينها (المعادن) نتيجة صعود محاليل كيمائية مركزة من باطن الأرض إلى قشرتها الخارجية, وترسبها بعد ذلك.[1]
معادن ثانوية
وتضم المعادن التي تعدلت, وتغيرت طبيعتها الأولى نتيجة تأثر المعادن الأولية الآنفة الذكر بعوامل التعرية, أو التحول . . . إلخ.
طرق تكون المعادن
أجريت في السنوات الأخيرة أبحاث عديدة لغرض معرفة الطرق المختلفة التي تكونت بها معادن قشرة الأرض, وقد تمحضت هذه البحوض عن معرفة طرائق عديدة وفيما يلي بعضها:
1-طريقة الضغط والحرارة: فمن المعروف أن أي معدن من المعادن - قبل أن يتخذ شكله الحالي - وقد مر من الحالة الغازية إلى المنصهرة إلى الصلبة, وأن أي إنخفاض في درجة الحرارة تتعرض له مادة "الصهير" لابد أن يؤدي إلى إرساب بعض المعادن التي تدخل في تكوينها, وأول ما يرسب من هذه المعادن هو اقلها إنصهاراً, وهذا يفسر تتباع العناصر المعدنية في بعض الخامات .ويؤثر عامل الضغط أيضاً على إنصهار المعادن المخلفة, إذ تؤدي زيادة الضغط إلى زيادة الإنصهار, كما يؤدي نقصانه - الذي قد ينتج عن صعود المحاليل المنصهرة إلى سطح الأرض خلال الشقوق والمفاصل التي توجد في الصخر - إلى الإرساب .
2-التبلور مباشرة من الصهير فعندما تبرد مادة الصهير (التي هي عبارة عن كتلة مائعة شبه منصهرة تتألف من مركبات السيلكا) إزاء إنخفاض درجة الحرارة, بحيث يصاحب البرودة تشبع الصهير من عنصر معين, لابد أ، يتبلور هذا العنصر بالبرودة. ولهذا نجد أنبعض المعادن الإقتصادية مثل الماجنيتايت , والكرومايت قد تكونت نتيجة تبلورها مباشرة من الصهير بفعل البرودة.
3-التسامي , إذ تتكون بعض المعادن بفعل الحرارة الشديدة التي قد تؤدي إلى تطاير بعض الفلزات واللافلزات مباشرة, أي تحولها من الحالة الصلبة إلى الغازية, ثم ترسب هذه المعادن مرة أخرى إذا ما إنخفضت درجة الحرارة, أو تغير الضغط , وهذا ما يحدث عادة عند فوهات البراكين. ومن أهم العناصر "المتسامسة" زهر الكبريت.
4-التقطير , إذ يعتبر بعض الجيولوجيين أن تكون البترول وما يرتبط يه من غازات طبيعية قد تم في الحقيقة فيباطن الأرض عن طريق عملية التقطير بطئ للمواد العضوية التي ترسب خلال الرواسب البحرية التي تتألف منها الصخور الرسوبية الساحلية.
5-الإفراط في التشبع والتبخر عندما تتعرض بعض المحاليل للتبخر, لابد أن يعقب هذا زيادة درجة تشبعها وبالتالي ترسب العناصر المذابة, وقد تكونت بهذه الطريقة قشور الكبريتات (مثل كبريتات النحاس, أو الزنك, أو الماغنسيوم, أو الكالسيوم) فوق سطح الأرض في المناطق الجافة, كما هي الحال في شيلي حيث تراكمت قشور من كبريتات النحاس في تشوكيكاماتا , ورانكاجوا في شمال شيلي, كما تراكمت في نفس هذا البلد, ونحن نفس اظروف رواسب النترات الهائلة في تاراباكا في مقاطعة أنتوفاجاستا, وفي شمال أتاكاما.
6-إرساب المعادن بواسطة البكتيريا: ومن أهم المعادن التي تترسب بهذه الطريقة, الحديد الخام, إذ توجد ثلاثة أنواع من البكتيريا المرسبة الحديد أشهرها النوع المعروف بإسم , ويعتقد عدد كبير من العلماء أن هذا النوع من أنواع البكتيريا هو اذلي ساعد على ترسيب تكوينات الحديد في مناطق شاسعة من العالم.
كما أنبكتيريا التربة العادية تعمل هي الأخرى على ترسيب المنجنيز الموجود في المياه الباطنية, وهذا هو فعلاً ما يسبب إنسداد عيون الآبار الإرتوازية في كثير من من جهات العالم.
وهنالك نوع ثان من البكتيريا يعيش تحت الماء ويساعد على ترسيب الكبريتات, أما النوع الثالث, وهو البكتيريا النباتية فيعد عاملاً رئيسياً في ترسيب السيلكا, وهذا ما يحدث في خزان أسوان في فترة التحاريق عندما ترتفع نسبة البكتيريا وتصبح عاملاً من العوامل التي تؤدي إلى زيادة معد الإرساب.
7-أثر التعرية : وهي من العمليات الهامة التي تساعد على تكوين المعادن الرئيسية. وتنقسم عمليات التعرية إلى قسمين: تعرية ميكانيكية وتعرية كيمائية, وعلى الرغم من أهمية التعرية الميكانيكية في نقل المعادن وتركيزها في أماكن وتركيزها في أماكن معينة, إلا أنها لا تعمل على خلق معادن جديدة مختلفة في صفاتها الكيمائية.
أما التعرية الكيمائية فتعمل على:
(أ) التأثير في المعادن الموجودة سواء في باطن الأرض أم على سطحها, وذلك عن طريق المياه (الباطنية أو السطحية) أو الأكسجين وثاني أكسيد الكربون. وقد تتغير خصائص بعض المعادم موضعياً , وقد تحمل المياه بعضها الآخر على شكل محاليل (أي وهي مذابة) ثم يتم ترسيبها بعد ذلك.
(ب) تؤثر التعرية الكيمائية في المعادن الهامشية - أي التي تعتبر في الأحوال العادية عديمة الجدوى من الناحية الإقتصادية - مثل ال (خام ردئ للنحاس) فتحولها وتغير طبيعتها وتصبح من المعادن التجارية الهامة.
(ج) تؤثر على الشوائب المعدنية مثل السيدارايت (كربونات الحديد) الذي يتحول إلى حديد بعد إذابة الكربونات.
(د) تؤثر التعرية الكيمائية تأثيراً مباشراً على الصخور, فالصخور التي تحتوي على عنصر الألومنيوم - مثلأً والتي توجد في الأقاليم المدارية تتحول إلى بوكسايت وهو الخام الرئيسي للألومنيوم, كما أن صخر السربنتين في جزيرة كيوبا, يتحول هو الآخر بواسطة العمليات الكيمائية الجوية إلى طبقة هشة تعرف باللاترايت الحديدي ويستخرج منها الحديد بكميات كبيرة في منطقة ماياري , كما أن لاترايت المنجنيز قد تكون بنفس الطريقة في شمال غرب الهند.
8-أثر عمليات التحول , إذ يؤدي الضغط أو الحرارة أو كلاهما معاً, إلى إعادة تشكيل وبلورة بعض العناصر المعدنية, وتحويلها إلى عناصر أخرى في خصائصها تمام الإختلاف. ولكثير من الصخور المتحولة أهمية إقتصادية كبيرة مثل العقيق (الذي يتركب من سليكات الحديد والألومنيوم, ويستخدم في أعمال الصقل), والجرافيت (الذي يستخدم في صنع أقلام الرصاص) والأردواز .
رؤية المعادن بالعين المجردة
يمكن أحيانأً رؤية المعادن المكونة لنوع معين من الصخر بواسطة العين المجردة, فإذا نظرنا مثلأً إلى قطعة من الجرانيت لاستطعنا أن نعرف تكوينها المعدني, ولاستطعنا أن نميز بين معدن الفلسبار - الذي يتكون من خليط من عناصر الصوديوم, والكالسيوم, والبوتاسيوم, بالإضافة إلى السيلكا وهو يتكون من بلورات بيضاء, أو رمادية, أو وردية اللون. الميكا الذي هو عبارة عن شظايا سمراء براقة. وبين معدن الكوارتز ذي اللون الأبيض وهو الذي يملأ الفراغ بين المعدنين الأولين. ولهذا نجد أن صخر الجرانيت يتكون من ثلاثة معادن رئيسية هي: الكوارتز ونسبته 31.3%, والفلسبار ونسبته 52.3%, والميكا 11.5%.
وتمييز معادن الصخر بواسطة العين كثيراً ما تحول دونه صعوبات عديدة, وذلك لأن المعدن عادة مايكون مختلطاً ببعض الشوائب الأخرى , كما أن معظم المعادن توجد في مركبات, إذ نجد بعضها مختلطاً بالكبريت, وبعضها الآخر متحداً مع بخار الماء او الجير, ولهذا يصعب تمييز المعدن وتشخصيه من وسط كل هذه الشوائب.
التركيب المعدني للحجر الرملي بواسطة العين المجردة
إنه عبارة عن ذرات من الكوارتز ملتحمة ببعضها البعض, ولهذا نجد أن الكوارتز يؤلف 70% تقريباً من التركيب المعدني للحجر الرملي, مع ملاحظة أن الكالسيت والدلومايت يتبعان الكوارتز في الأهمية إذ يعتبران بمثابة المواد اللاحمة التي عملت على تماسك ذرات معدن الكوارتز.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المعادن الرئيسية التي تتكون منها الصخور المختلفة
على الرغم من أن المعروف منها يزيد على 2000 معدن إلا أنه يمكن القول بأن التركيب المعدني لكثير من الأنواع الصخرية يمكن الإلمام به في حدود معرفة ما يقرب من 12 معدناً.
وتتكون معظم هذه المعادن من أكثر من عنصر كيمائي واحد (ولو أن بعضها مثل الذهب والنحاس والكبريت يمثل عنصراً واحداً) فالكوارتز مثلأً يتكون من عنصري الأوكسجين, والسيلكون, وهو يدخل في تركيب الرجانيت والصخورالرملية والجيرية.
تشخيص المعادن
هنالك بضع طرق يمكن بواسطتها تشخيص المعادن منها:
1- معرفة بريق المعادن , فبعض المعادن لها بريق معدني مثل الذهب, والجالينا (خام الرصاص), وبعضها الآخر ليس له بريق معدني بل قد تكون زجاجية الملمس (مثل ملح الطعام, والكالسيت), أو شحمية (مثل الكبريت), أو حريرية (مثل الأسبستوس والجبس).
2-معرفة شكل المعدن, فقد تكون بعض المعادن على هيئة عنقودية مثل الكالسيدوني, أو شجرية مثل المنجنيز, أو ليفية مثل الأسبستوس, أو كلوية مثل بعض خامات الحديد (الليمونايت).
3-معرفة درجة الصلادة , إذ أن المعادن الصلدة تخدش الأقل صلادة’ فالماس يخدش الياقوت (الكورندوم), والياقوت يخدشض التوباز, والتوباز يخدش الكوارتز, والكوارتز يخدش أكسيد الحديد الأحمر (الهيماتيت) وهذا بدوره يخدش الكالسايت, والكالسايت أكثر صلادة من الجبس, والأخير أكثر صلابة من التلك.
4-معرفة التشقق , فالميكا مثلأً على شكل شرائح رقيقة جداً في إتجاه واحد, والكوارتز لا يتشقق, والهورنبلند يتشقق في أكثر من إتجاه.
5-معرفة الكثافة النوعية , إذ قد تتشابه المعادن في اللون أو البريق أو الشكل, ولكنها تختلف في كثافتها النوعية (التي هي عبارة عن النسبة بين وزن المعدن في الهواء, والفرق بين وزنه في الهواء والماء).
6-معرفة التكسر , إذ إن بعض المعادن إذا ما تكسرت يصبح سطحها أملس ويصبح بعضها أيضاً ذا سطح خشن غير منتظم.
7-معرفة الشكل البلوري , وهذه أهم وسيلة من وسائل تشخيص المعادن, فكل معدن من المعادن المتبلورة تنتظم ذراته في أشكال هندسية معينة, أما المعادن غير المتبلورة فليس لذراتها نظام معين, والفرق بين هذين النوعين يشبه الفرق بين جيش إنتظم جنوده في كتائب وتشكيلات مرسومة وفق خطة معينة, وبين جموع من المتظاهرين المتناثرين هنا وهناك.
وقد كان "نيكولاوس ستينو", أول من أرسى قواعد علم البلورات (سنة 1669) مما أدى بعد ذلك إلى القانون المعروف بقانون ثبات السطوح البللورية , فبلورة الملح مثلاً تبدو على شكل مكعب وبلورة الكوراتز أو الكالسايت سداسية وبلورة القصدير رباعية وهلم جرا.
تقسيم المعادن في المعتاد
تنقسم المعادن في المعتاد إلى قسمين رئيسيين:
معادن أولية
يقصد بها تلك المعادن التي تكونت أول ما تكونت أثناء فترة تكوين المعادن في فجر حياة الكرة الأرضية, وقد كان تكوينها (المعادن) نتيجة صعود محاليل كيمائية مركزة من باطن الأرض إلى قشرتها الخارجية, وترسبها بعد ذلك.
معادن ثانوية
تضم المعادن التي تعدلت, وتغيرت طبيعتها الأولى نتيجة تأثر المعادن الأولية الآنفة الذكر بعوامل التعرية, أو التحول . . . إلخ.
طرق تكوين المعادن
أجريت في السنوات الأخيرة أبحاث عديدة لغرض معرفة الطرق المختلفة التي تكونت بها معادن قشرة الأرض, وقد تمحضت هذه البحوث عن معرفة طرائق عديدة وفيما يلي بعضها:
طريقة الضغط والحرارة
من المعروف أن أي معدن من المعادن - قبل أن يتخذ شكله الحالي - وقد مر من الحالة الغازية إلى المنصهرة إلى الصلبة, وأن أي إنخفاض في درجة الحرارة تتعرض له مادة "الصهير" لابد أن يؤدي إلى إرساب بعض المعادن التي تدخل في تكوينها, وأول ما يرسب من هذه المعادن هو اقلها إنصهاراً, وهذا يفسر تتباع العناصر المعدنية في بعض الخامات .ويؤثر عامل الضغط أيضاً على إنصهار المعادن المخلفة, إذ تؤدي زيادة الضغط إلى زيادة الإنصهار, كما يؤدي نقصانه - الذي قد ينتج عن صعود المحاليل المنصهرة إلى سطح الأرض خلال الشقوق والمفاصل التي توجد في الصخر - إلى الإرساب .
التبلور مباشرة من الصهير
عندما تبرد مادة الصهير (التي هي عبارة عن كتلة مائعة شبه منصهرة تتألف من مركبات السيلكا) إزاء إنخفاض درجة الحرارة, بحيث يصاحب البرودة تشبع الصهير من عنصر معين, لابد أن يتبلور هذا العنصر بالبرودة. ولهذا نجد أن بعض المعادن الإقتصادية مثل الماجنيتايت , والكرومايت قد تكونت نتيجة تبلورها مباشرة من الصهير بفعل البرودة.
التسامي
تتكون بعض المعادن بفعل الحرارة الشديدة التي قد تؤدي إلى تطاير بعض الفلزات واللافلزات مباشرة, أي تحولها من الحالة الصلبة إلى الغازية, ثم ترسب هذه المعادن مرة أخرى إذا ما إنخفضت درجة الحرارة, أو تغير الضغط , وهذا ما يحدث عادة عند فوهات البراكين. ومن أهم العناصر "المتسامسة" زهر الكبريت.
التقطير
يعتبر بعض الجيولوجيين أن تكون البترول وما يرتبط يه من غازات طبيعية قد تم في الحقيقة في باطن الأرض عن طريق عملية التقطير بطئ للمواد العضوية التي ترسب خلال الرواسب البحرية التي تتألف منها الصخور الرسوبية الساحلية.
الإفراط في التشبع والتبخر
عندما تتعرض بعض المحاليل للتبخر, لابد أن يعقب هذا زيادة درجة تشبعها وبالتالي ترسب العناصر المذابة, وقد تكونت بهذه الطريقة قشور الكبريتات (مثل كبريتات النحاس, أو الزنك, أو الماغنسيوم, أو الكالسيوم) فوق سطح الأرض في المناطق الجافة, كما هي الحال في شيلي حيث تراكمت قشور من كبريتات النحاس في تشوكيكاماتا , ورانكاجوا في شمال شيلي, كما تراكمت في نفس هذا البلد, وتحت نفس الظروف رواسب النترات الهائلة في تاراباكا في مقاطعة أنتوفاجاستا, وفي شمال أتاكاما.
إرساب المعادن بواسطة البكتيريا
من أهم المعادن التي تترسب بهذه الطريقة, الحديد الخام, إذ توجد ثلاثة أنواع من البكتيريا المرسبة الحديد أشهرها النوع المعروف بإسم Crenothrix, ويعتقد عدد كبير من العلماء أن هذا النوع من أنواع البكتيريا هو الذي ساعد على ترسيب تكوينات الحديد في مناطق شاسعة من العالم.
كما أن بكتيريا التربة العادية تعمل على ترسيب المنجنيز الموجود في المياه الباطنية, وهذا هو فعلاً ما يسبب إنسداد عيون الآبار الإرتوازية في كثير من من جهات العالم.
وهنالك نوع ثان من البكتيريا يعيش تحت الماء ويساعد على ترسيب الكبريتات, أما النوع الثالث, وهو البكتيريا النباتية فيعد عاملاً رئيسياً في ترسيب السيلكا, وهذا ما يحدث في خزان أسوان في فترة التحاريق عندما ترتفع نسبة البكتيريا وتصبح عاملاً من العوامل التي تؤدي إلى زيادة معد الإرساب.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
أثر التعرية
هي من العمليات الهامة التي تساعد على تكوين المعادن الرئيسية. وتنقسم عمليات التعرية إلى قسمين:
تعرية ميكانيكية
على الرغم من أهمية التعرية الميكانيكية في نقل المعادن وتركيزها في أماكن وتركيزها في أماكن معينة, إلا أنها لا تعمل على خلق معادن جديدة مختلفة في صفاتها الكيمائية.
تعرية كيمائية
التعرية الكيمائية تعمل على:
(أ) التأثير في المعادن الموجودة سواء في باطن الأرض أم على سطحها, وذلك عن طريق المياه (الباطنية أو السطحية) أو الأكسجين وثاني أكسيد الكربون. وقد تتغير خصائص بعض المعادن موضعياً , وقد تحمل المياه بعضها الآخر على شكل محاليل (أي وهي مذابة) ثم يتم ترسيبها بعد ذلك.
(ب) تؤثر التعرية الكيمائية في المعادن الهامشية - أي التي تعتبر في الأحوال العادية عديمة الجدوى من الناحية الإقتصادية - مثل ال (خام ردئ للنحاس) فتحولها وتغير طبيعتها وتصبح من المعادن التجارية الهامة.
(ج) تؤثر على الشوائب المعدنية مثل السيدارايت (كربونات الحديد) الذي يتحول إلى حديد بعد إذابة الكربونات.
(د) تؤثر التعرية الكيمائية تأثيراً مباشراً على الصخور, فالصخور التي تحتوي على عنصر الألومنيوم - مثلأً والتي توجد في الأقاليم المدارية تتحول إلى بوكسايت وهو الخام الرئيسي للألومنيوم, كما أن صخر السربنتين في جزيرة كيوبا, يتحول هو الآخر بواسطة العمليات الكيمائية الجوية إلى طبقة هشة تعرف باللاترايت الحديدي ويستخرج منها الحديد بكميات كبيرة في منطقة ماياري , كما أن لاترايت المنجنيز قد تكون بنفس الطريقة في شمال غرب الهند.
8-أثر عمليات التحول , إذ يؤدي الضغط أو الحرارة أو كلاهما معاً, إلى إعادة تشكيل وبلورة بعض العناصر المعدنية, وتحويلها إلى عناصر أخرى في خصائصها تمام الإختلاف. ولكثير من الصخور المتحولة أهمية إقتصادية كبيرة مثل العقيق (الذي يتركب من سليكات الحديد والألومنيوم, ويستخدم في أعمال الصقل), والجرافيت (الذي يستخدم في صنع أقلام الرصاص) والأردواز .
مجموعة معدنية
وهي تصف المعدن الذي يحدث فيه إحلال كاتيوني, دون تغير في نسبة الكاتيونات إلى الأنيونات.
أشباه المعادن
ويكون تركيبه الكيمائي غير ثابت ومتغير وغير متبلور مثل الزجاج الموجود في الطبيعة. وقد يكون له تركيب كيمائي ثابت ولكنه غير متبلور مثل الأوبال.
الخواص الفيزيائية للمعادن
البنية البلورية
 مقالات مفصلة: نظام كريستال
مقالات مفصلة: نظام كريستال - Crystal habit

| Crystal family | Lengths | Angles | Common examples |
|---|---|---|---|
| Isometric | a=b=c | α=β=γ=90° | Garnet, halite, pyrite |
| Tetragonal | a=b≠c | α=β=γ=90° | Rutile, zircon, andalusite |
| Orthorhombic | a≠b≠c | α=β=γ=90° | Olivine, aragonite, orthopyroxenes |
| Hexagonal | a=b≠c | α=β=90°, γ=120° | Quartz, calcite, tourmaline |
| Monoclinic | a≠b≠c | α=γ=90°, β≠90° | Clinopyroxenes, orthoclase, gypsum |
| Triclinic | a≠b≠c | α≠β≠γ≠90° | Anorthite, albite, kyanite |

توجد المعادن في أشكال بلورية مختلفة والبلورة عبارة عن جسم من وسط صلب متجانس التركيب الكيميائي ويحدها أسطح ومستويات طبيعية تعرف باسم أوجه البلورة وتتميز بوجود علاقات تماثل معينة. ويمكن تقسيم البلورات عادة إلى سبعة نظم بلورية وذلك على أساس أطوال المحاور البلورية أ ، ب ، ج ، والزوايا البلورية α ، β ، γ ، والنظم البلورية السبعة هي:
1- نظام المكعب
ويمتاز هذا النظام بثلاثة محاور بلورية متساوية ومتعامدة.أي إن:
أ = ب = ج ، α = β = γ = 90° وتمثل هذا النظام بلورة الألماس.
2- نظام الرباعي
ويمتاز هذا النظام بثلاثة محاور بلورية متعامدة، المحوران الأفقيان متساويان والمحور الثالث رأسي وهو أطول وأقصر منهما، أي إن:
أ = ب ≠ ج ، α = β = γ = 90° ويمثل هذا النظام الزيركون.
2- نظام السداسي :
ويمتاز هذا النظام بأربعة محاور بلورية ، ثلاثة منها أفقية ومتساوية ومتبادلة وتتقاطع في زوايا مقدارها 120° درجة والمحور الرابع رأسي أطول أو أقصر منها وعمودي على مستواها، أي إن:
أ1 = أ 2 = أ 3 ≠ 90°، γ = 120° ويمثل هذا النظام بلورة البيريل.
4- نظام الثلاثي:
ويمتاز هذا النظام بأربعة محاور بلورية مثل النظام السداسي. وهما متشابهان من حيث عدد
المحاور البلورية وكيفية توزيعها والاختلاف الوحيد بينهما هو أن المحور ( ج ) في النظام الثلاثي
محور تماثل بينما في النظام السداسي محور تماثل سداسي. وتمثل هذا النظام بلورة الكوراندوم.
5- نظام المعيني القائم :
ويمتاز هذا النظام بثلاثة محاور بلورية غير متساوية ولكنها متعامدة، أي أن:
أ ≠ ب ≠ ج ، γ = β = α = 90° وتمثل هذا النظام بلورة الكبريت المعين.
6- نظام احادي الميل:
ويمتاز هذا النظام بثلاثة محاور غير متساوي والمحور ( ب ) عمودي على مستوى أ ، ج لكن المحور ميل على مستو المحورين ب ، ج ، أي أن:
أ ≠ ب ≠ ج ، γ = α = 90° ≠ β ، وتمثل هذا النظام بلورة الأورثوكليز.
7- نظام ثلاثي الميل:
ويمتاز هذا النظام بثلاثة محاور بلورية غير متساوية وتتقاطع في زوايا غير متساوية أيضاً، أي إن :
أ ≠ ب ≠ ج ، α ≠ β ≠ γ = 90° ويمثل هذا النظام بلورة الميكروكلين.
الصلابة
 مقالة مفصلة: مقياس موس للصلابة المعادن
مقالة مفصلة: مقياس موس للصلابة المعادن
| Mohs hardness | Mineral | Chemical formula |
|---|---|---|
| 1 | Talc | Mg3Si4O10(OH)2 |
| 2 | Gypsum | CaSO4•2H2O |
| 3 | Calcite | CaCO3 |
| 4 | Fluorite | CaF2 |
| 5 | Apatite | Ca5(PO4)3(OH,Cl,F) |
| 6 | Orthoclase | KAlSi3O8 |
| 7 | Quartz | SiO2 |
| 8 | Topaz | Al2SiO4(OH,F)2 |
| 9 | Corundum | Al2O3 |
| 10 | Diamond | C |
Lustre and diaphaneity
 مقالة مفصلة: تلألأ (المعادن)
مقالة مفصلة: تلألأ (المعادن)

اللون و streak
 مقالة مفصلة: Streak (mineralogy)
مقالة مفصلة: Streak (mineralogy)
يعد اللون من الصفات الطبيعية المهمة لتمييز المعادن خارجياً وخاصة في المعادن الفلزية ولكن اللون لا يعد صفة ثايتة للمعادن في أغلب الأحيان ولذلك لا يمكن الاعتماد على اللون لمعرفة المعادن. ويمكن تقسيم المعادن من حيث اللون إلى قسمين: معادن ذات ألوان ثابتة مثل اللون الأزرق لمعدن الأزيورايت واللون الأصفر للذهب والبيريت واللون الأحمر للنحاس. ومعادن ذات ألوان غير ثابتة مثل معدن
الفلوريت الذي يكون غالباً ذا لون أخضر أو أصفر أو لون أبيض أو بني أو قرمزي أو عديم اللون نتيجة لوجود مواد ملونة على هيئة شوائب أو مواد دخيلة، ويتوقف اللون على نوع الضوء الذي يمتصه أو يعكسه المعدن.
2- المخدش:
وهو لون ما مسحوق المعدن الناعم. ويمكن الحصول عليه بواسطة حك المعدن المراد فحصه على السطح غير اللامع بقطعة من الخزف تعرف بلوح المخدش. وتعطي معادن الحديد السوداء اللون مثل الماجناتيت والهيماتيت والألمناتيت مخدشاً مميزاً لكل واحد منهم، فالهيماتيت مخدشه أحمر بينما الماجناتيت أسود بينما الألمناتيت مخدشه محمر. وقد يتشابه لون المخدش مع لون المعدن كما هو الحال في كل من معدني الليمونايت والجرافايت ويلاحظ أن معظم المعادن ذات البريق اللافلزي لها مخدش ذو لون أبيض أو فاتح ولهذا فإن خاصية المخدش ليست بالصفة التي يمكن الاعتماد عليها عند الرغبة في التفريق بين المعادن ذات البريق اللافلزي.
3- الشفافية:
تعتمد هذه الخاصية على قدرة المعدن على إنفاذ الضوء خلاله وتنقسم المعادن من حيث الشفافية إلى ثلاثة أنواع:
أ- معادن الشفافية :
وهي المعادن التي تسمح بمرور معظم الضوء الساقط عليها ويمكن رؤية لأجسام من خلالها بسهولة مثل أنواع الكوارتز والكالسيت.
ب-معادن نصف شفافية:
وهي معادن تنفذ الضوء بكمية أقل من المعادن الشفافة ولا تسمح برؤية الأجسام خلالها مثل معدن الأوبال.
ج- معادن معتمة:
وهي المعادن التي لا تسمح بمرور الضوء حتى من خلال شرائحها الرقيقة مثل معادن الماجنايت والبايرايت والجالينا.
4- البريق:
وهو مظهر سطح المعدن عندما ينعكس عليه الضوء. ويمكن تقسيم المعادن تبعاً لهذه الخاصية لقسمين:
(أ) معادن ذات بريق فلزي مثل بريق الذهب والبارايت.
(ب) معادن ذات بريق لافلزي.
ويمكن تقسيم البريق اللافلزي إلى أنواع مختلفة أهمها:
البريق الزجاجي : مثل بريق معدن الكوارتز.
البريق الؤلؤي : مثل بريق معدن التلك.
البريق الحريري : مثل بريق معدن الأسبستوس.
البريق الصمغي : مثل بريق معدن السفاليرات والكبريت.
البريق الماسي : مثل بريق معدن الألماس.
البريق الترابي : مثل بريق معدن البوكسايت.
Cleavage, parting, fracture, and tenacity
 مقالات مفصلة: Cleavage (crystal)
مقالات مفصلة: Cleavage (crystal)- Fracture (mineralogy)

الجاذبية النوعية
خصائص أخرى
الناقلية الحرارية والكهربائية
إن سهولة تنقل الإلكترونات في كتلة المعدن تولد ناقليـة جيدة للحرارة والكهرباء. فالمعادن جيدة النقـل للحرارة تكون جيدة النقل للكهربـاء أيضـاً. وإن الفضـة والنحاس من أجود المعادن ناقلية للحرارة والكهرباء في حين يعدّ الرصاص والزئبق من أسوئها.
تعلَّل الناقلية الحرارية والكهربائية في المعادن وانخفاضها في أشباه المعادن واللامعادن بأن حالة الإلكترونات الخارجية في الذرة الحرة لعنصر تختلف عن حالتها عندما تتجمع ذرات العنصر لتشكل كتلة متراصة، في حين تحافظ الإلكترونات الداخلية على حالتها الطاقية. ففي الذرات الحرة تكون الإلكترونات الخارجية (إلكترونات التكافؤ) ذات طاقات محددة، أو بتعبير آخر، تشغل سويات طاقة محددة. أما في كتلة العنصر عندما تصبح هذه الإلكترونات خاضعة لتأثير عدد كبير من النوى تزداد السويات الطاقية الممكنة لهذه الإلكترونات حتى قيم أعلى، أو بتعبير آخر، تشغل هذه الإلكترونات منطقة طاقية عريضة محدّدة أعلى من سويات الطاقة الموافقة في الذرات الحرة، ومن ثم تصبح الطاقة اللازمة لتهييج الإلكترون الخارجي كي ينتقل إلى حالة طاقية أعلى أو لخروجه من الغلاف الإلكتروني أصغر بكثير، ويكفي لذلك حقل صغير أو طاقة حرارية صغيرة. وكلما كان الفرق بين سويتي الطاقتين الموافقتين للحالة العادية والحالة المهيَّجة صغيراً (في حالة وجود مناطق طاقية شاغرة) كانت الناقلية الحرارية والكهربائية كبيرة، وهذه هي الحال في حالة المعادن بعكس اللامعادن.
تتميز المعادن النموذجية من اللامعادن أيضاً بخاصة اصدار إلكترونات عند تسخينها. وهي تُقسم حسب كتلتها الحجمية إلى قسمين: معادن خفيفة لا تزيد كتلتها الحجمية على 5غرام/السنتمتر المكعب، ومعادن ثقيلة وهي المعادن الأخرى. وتكون المعادن الخفيفة عموماً سهلة الانصهار والغليان بعكس المعادن الثقيلة التي درجات انصهارها ودرجات غليانها عالية. وأخفض درجة انصهار بعد درجة انصهار الزئبق - 38.87 ْس، هي للسيزيوم 28 ْس، وأعلاها للتنغستن 3410 ْس. وأبخرة المعادن النموذجية، غالباً، تكون في الحالة الذرية بخلاف اللامعادن في الحالة الغازية (باستثناء الغازات الخاملة).
الخواص الكيمياوية المعدنية


تتحدُّد كهرجابية العناصر كمياً بقيم كمون المسرى النظامي الموافقة لها مقدرة بالڤولط، وتنظم هذه القيم في جدول هو الجدول الكهرحركي.
Li+/Li
-3.045
Rb+/Rb
-2.925
Ba2+/Ba
-2.90
Al3+/Al
-1.7
2H+/H2
0.00
Bi3+/Bi
+0.20
Cu2+/Cu
+0.34
F2/2F-
+2.87
قيم كمونات المساري النظامية لبعض العناصر
للجدول الكهرحركي أهمية بالغة في كيمياء المعادن. فكل معدن في الجدول يزيح مبدئياً المعادن التي تليه من محاليلها. فالليثيوم يزيح الألمنيوم من محاليله. وبصورة عامة تتفاعل المعادن التي تقع فوق الهدروجين (أي التي كمونات مساريها سالبة) مع الحموض الممددة مطلقة الهدروجين، أما المعادن التي تليه فلا تتفاعل في الشروط نفسها، كما أن المعادن شديدة الكهر جابية تزيح الهدروجين من الماء أيضاً.
المعادن الانتقالية
هي العناصر التي تحتوي في تركيبها الإلكتروني في الحالة الأساسية على طبقات ثانوية d و/أو f مملوءة جزئياً (غير مشبعة)، وهي تشكل ثلاث مجموعات من الجدول الدوري.
أ - تشمل المجموعة الأولى ثلاث سلاسل:
1- السلسة الأولى: تمتد من الاسكنديوم Sc إلى النيكل ويجري فيها إشباع الطبقة الثانوية 3d.
2- السلسلة الثانية: تشمل العناصر من الإتريوم إلى البلاديوم ويجري فيها إشباع الطبقة 4d.
3- السلسلة الثالثة: وتبدأ باللانثانوم وتنتهي بالبلاتين ويدخل فيها الإلكترون الأول الطبقة الإلكترونية 4f ثم يجري إشباع الطبقة 5d.
ب - تشمل المجموعة الثانية العناصر من اللانثانوم إلى اللوتيسيوم ويتم فيها إشباع الطبقة الثانوية 4f تدريجياً وتدعى هذه المجموعة «اللانتانيدات».
ج- تبدأ المجموعة الثالثة بالأكتينيوم وتنتهي بعنصر اللورنسيوم (عدده الذري 103). ويتم في هذه المجموعة ملء الطبقة 5f من الأكتينيوم إلى اللورنسيوم، ويُطلق عليها اسم فصيلة الأكتينيدات، ومن ثم يستمر امتلاء الطبقة 6d جزئياً في العناصر التي تلي زمرة الأكتينيدات إلى آخر الجدول الدوري.
- إذا أضيف إلى العناصر السابقة العناصر التي لها أيونات ذات طبقات إلكترونية d غير مشبعة؛ فيمكن عدّ النحاس والفضة والذهب عناصر انتقالية أيضاً.
- بالرغم من وجود فصيلة الزنك في آخر السلاسل d لايمكن عدّ عناصرها انتقالية.
- بالرغم من التركيب الإلكتروني الخارجي لكل من اللانثانيوم (6s25d1) (واللوتيسيوم) (6s25d14f14) والذي يجعل تلك العناصر انتقالية فمن المستحسن، بالاعتماد على خواصها الكيمياوية، دراستهما في زمرة «اللانتانيدات» وكذلك الأمر بالنسبة إلى الأكتينيوم.
العناصر الانتقالية d معادن نموذجية بخواصها الفيزيائية؛ فهي ناقلة للحرارة والكهرباء وقابلة للسحب والطرق، وتكوِّن سبائك، مثل باقي المعادن، مع المعادن الأخرى. وحجوم ذراتها (نظراً لامتلاء المدارات الداخلية بالإلكترونات) صغيرة إذا ما قورنت بعناصر الفصيلتين القلوية والقلوية الترابية لذا فإن كثافتها عالية.
تتميز المعادن الانتقالية بارتفاع درجات غليانها وانصهارها. فجميعها باستثناء الفضه واللانثانوم تنصهر فوق الدرجة 1000 ْس(تنصهر الفضة بالدرجة 961). كما أن قيم كمون تأين العناصر الانتقالية وسط بين قيم كمون تأين عناصر المجموعتين s وp الكائنتين في الدور ذاته، وهذا يجعل تلك العناصر أقل كهر جابية من عناصر المجموعة s.
تتصف العناصر الانتقالية بصورة عامة بعدة درجات أكسدة، ويرجع هذا إلى إمكان نزع الإلكترونات من الطبقتين الثانويتين d أو s التي لها مستويات طاقة متقاربة. يكون عدد الأكسدة الأعلى رقم الفصيلة بالجدول الدوري، أما القيمة الدنيا لهذا العدد فهي تساوي 2. وتشكل العناصر الانتقالية روابط أيونية عندما تكون هذه العناصر في أدنى درجة أكسدة. أما في درجات الأكسدة الأعلى، فتكون الروابط مشتركة.
تكوِّن معظم العناصر الانتقالية أيونات ملّونة ويعلّل ذلك بتقارب مستويات الطاقة d وs؛ إذ يمكن للإلكترون d الانتقال من مستوى طاقة منخفض إلى مستوى طاقة أعلى منه. ويكون هذا التحول إما من d إلى s أو من nd إلى nd آخر نتيجة انقسام سويات الطاقة d تحت تأثير الحقل البلوري أو نتيجة تشكل مدارات جزيئية رابطة أو غير رابطة. وينتقل الإلكترون من سوية طاقة إلى أخرى بامتصاصه جزءاً فقط من طاقة الضوء المرئي ويصبح الأيون ملوناً باللون المتمم للضوء الممتَص.
تتصف العناصر الانتقالية وكذلك أيوناتها بوجه عام بمغناطيسية طردية، ويرجع ذلك إلى وجود إلكترونات عازبة في الطبقات غير المشبعة لتلك العناصر أو الأيونات.
وتتصف أيونات العناصر الانتقالية بميلهـا الواضح إلى تشـكيل معقـدات[ر. المعقَّد]، ويُعزى هذا الميل إلى وجود مدارات شاغرة في بنيتها الإلكترونية.
للعناصر d أهمية خاصة في المتعضيات الحية، وفي عمليات صناعية كثيرة، وكمواد للاستعمال. مثال ذلك الكوبلت الذي يؤدي دوراً حفّازاً مهماً في الفيتامين B12. والحديد عنصر رئيسي في عمليات الأكسدة - إرجاع الكيمياوية الحيوية باستعمال الهيموجلوبين أو المايوجلوبين. المولبدن والحديد، مع الكبريت، يكوِّنان الجزء الفعّال من النتروجيناز، وهو حفّاز حيوي تستعمله النباتات لتحويل الآزوت الجوي إلى أمونيا]]، والنحاس والزنك عنصران مهمان في حفّازات بيولوجية أخرى. كما تقوم بعض هذه العناصر بدور حفّازات في تفاعلات غير بيولوجية، مثال ذلك الحديد الذي يستعمل حفّازاً في صناعة الأمونيا، والنيكل يستعمل حفّازاً في هدرجة الزيوت.
تُستعمل مركبات هذه العناصر في الدهانات والأصبغة والملوِّنات pigments لكونها ملوّنة. وتُستعمل ضروب السيليكات وأكسيد الألمنيوم عند احتوائها أيونات المعادن الانتقالية أحجاراً كريمة. فمثلاً ضروب الياقوت rubies تحوي Cr3+التي حلّت محل أيونات Al3+في الشبكة البلورية لـ Al2O3، فالمعدن الانتقالي يمنح اللون الأحمر إلى المادة، ولهذا السبب تستعمل ضروب الياقوت ليزرات. ويلوَّن الزجاج باللون الأزرق بإضافة كميات صغيرة من ملح CO2+
للمعادن الانتقالية وسبائكها استعمالات كثيرة في الصناعة. فمنها تصك النقود في كثير من البلاد، كما تدخل في صناعة السيارات والأجهزة المختلفة. يصنّع سنوياً ما يزيد على 700 مليون طن من الفولاذ، وأكثر من ثمانية ملايين طن من النحاس، وأكثر من 750 ألف طن من النيكل عالمياً لسد حاجة الصناعات المختلفة.[2]
الطبقات المعدنية
سيليكات
 مقالة مفصلة: معادن سيليكات
مقالة مفصلة: معادن سيليكات

Tectosilicates
 مقالة مفصلة: Tectosilicates
مقالة مفصلة: Tectosilicates

Phyllosilicates
 مقالة مفصلة: Phyllosilicates
مقالة مفصلة: Phyllosilicates
Inosilicates
 مقالة مفصلة: Inosilicates
مقالة مفصلة: Inosilicates
Cyclosilicates
 مقالة مفصلة: Cyclosilicates
مقالة مفصلة: Cyclosilicates
Sorosilicates
 مقالة مفصلة: Sorosilicates
مقالة مفصلة: Sorosilicates
Orthosilicates
 مقالة مفصلة: Nesosilicates
مقالة مفصلة: Nesosilicates
غير سيليكات
العناصر الأصلية
 مقالة مفصلة: عناصر المعادن الأصلية
مقالة مفصلة: عناصر المعادن الأصلية
كبريتيدات
 مقالة مفصلة: كبريتيدات المعادن
مقالة مفصلة: كبريتيدات المعادن
أكاسيد
 مقالة مفصلة: أكاسيد المعادن
مقالة مفصلة: أكاسيد المعادن
الهاليدات
 مقالة مفصلة: هالايدات المعادن
مقالة مفصلة: هالايدات المعادن

الكربونات
 مقالة مفصلة: كربونات المعادن
مقالة مفصلة: كربونات المعادن
الكبريتات
 مقالة مفصلة: كبريتات المعادن
مقالة مفصلة: كبريتات المعادن
الفوسفات
 مقالة مفصلة: فوسفات المعادن
مقالة مفصلة: فوسفات المعادن
المعادن العضوية
 مقالة مفصلة: المعادن العضوية
مقالة مفصلة: المعادن العضوية
القيمة الحيوية للمعادن
الأملاح المعدنية عناصر أساسية لقيام الجسم بوظائفه الحيوية على الرغم من وجودها في الجسم بكميات ضئيلة ، مثل الكالسيوم والحديد والنحاس والزنك والمنجنيز والكوبلت واليود وغيرها. ونقص أحد هذه الأملاح يسبب تأثيرات فسيولوجية كبيرة ، فمثلا غياب اليود من جسم الإنسان يسبب عدم قيام الغدة الدرقية بإنتاح الهرمون المنظم لعملية الهضم وهو الثيروكسين والذي يكون اليود 56ِ% من وزنه ، كما ينتج من نقص الحديد في الجسم مرض الأنيميا كما يدخل الحديد في تركيب الهيموگلوبين.
انظر أيضاً
- علم المعادن
- قائمة المعادن
- أساسيات الجيولوجيا الفيزيائية
- Dietary mineral
- Mineral collecting
- Nonmineral
- A list of minerals with associated Wikipedia articles
- A comprehensive list of minerals
- Tucson Gem & Mineral Show
- Industrial minerals
- مياه معدنية
- Mineral processing
- صوف معدني
- تعدين
- Norman L. Bowen
- Quarry
- عنصر القلة
- صخور
- Strunz classification
قائمة المراجع
- Busbey, A.B.; Coenraads, R.E.; Roots, D.; Willis, P. (2007). Rocks and Fossils. San Francisco: Fog City Press. ISBN 978-1-74089-632-0.
- Chesterman, C.W.; Lowe, K.E. (2008). Field guide to North American rocks and minerals. Toronto: Random House of Canada. ISBN 0-394-50269-8.
- Dyar, M.D.; Gunter, M.E. (2008). Mineralogy and Optical Mineralogy. Chantilly, Virginia: Mineralogical Society of America. ISBN 978-0-939950-81-2.
وصلات خارجية
| Minerals
]].- mindat.org Mindat database
- Webmineral.com
- Mineral atlas with properties, photos
- Ontogeny of minerals in drawings. Drawings of crystals, druses, and mineral aggregates. Every work here may illustrate genetic features of minerals (their history, or ontogenesis, and formative processes).
- "Mineralogy Database" by David Barthelmy (2009)
- "Mineral Identification Key II" Mineralogical Society of America
- "American Mineralogist Crystal Structure Database"
المصادر