تبلور
| التبلور | |
|---|---|
 | |
| الأسس | |
| المفاهيم | |
| الطرق والتكنولوجيا | |
التبلور (أو البَلْوَرَة) Crystallization هي عملية تشكـُّل (طبيعية كانت أم اصطناعية) للبلورات الصلبة من محلول، حيث تنتظم الذرات أو الجزيئات في بنية تـُعرَف بإسم بلورة. بعض الطرق التي تتشكل بها البلورات هي الترسيب من محلول، التجميد، أو في حالات نادرة الترسيب مباشرة من الغاز. تعتمد سمات البلورة الناتجة إلى حد كبير على عوامل مثل درجة الحرارة، وضغط الهواء، ومعدل التبريد، وفي حالة البلورات السائلة، وقت تبخر السائل.
يحدث التبلور في خطوتين رئيسيتين. الأولى هي التنوي، وهو ظهور الطور البلوري إما من سائل التبريد الفائق أو من مذيب فائق التشبع. الخطوة الثانية تعرف بنمو البلورات، وهي زيادة حجم الجزيئات وتؤدي إلى الحالة البلورية. إحدى السمات الهامة لهذه الخطوة هي أن الجزيئات السائبة تشكل طبقات على سطح البلورة وتستقر في تناقضات مفتوحة مثل المسام والشقوق وما إلى ذلك.
تتبلور غالبية الجزيئات المعدنية والعضوية بسهولة، وتكون البلورات الناتجة ذات نوعية جيدة بشكل عام، أي بدون عيوب مرئية. ومع ذلك، فإن الجسيمات الكيميائية الحيوية الأكبر حجمًا، مثل الپروتينات، غالبًا ما تكون صعبة التبلور. تعتمد السهولة التي تتبلور بها الجزيئات بشدة على شدة القوى الذرية (في حالة المواد المعدنية)، أو القوى بين الجزيئات (المواد العضوية والكيميائية الحيوية) أو القوى داخل الجزيئات (المواد الكيميائية الحيوية).
التبلور هو أيضًا أسلوب كيميائي لفصل المواد الصلبة والسائلة، حيث يحدث انتقال الكتلة من المذاب من المحلول السائل إلى الطور البلوري الصلب النقي. في الهندسة الكيميائية، يحدث التبلور في المبلور. لذلك يرتبط التبلور بالترسيب، على الرغم من أن النتيجة ليست غير متبلورة أو مضطربة، لكنها بلورة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العملية
تتكون عملية التبلور من حدثين رئيسيين، التنوي والنمو البلوري والتي تحركها الخصائص الديناميكية الحرارية بالإضافة إلى الخصائص الكيميائية. التنوي هي الخطوة التي تبدأ فيها جزيئات المذاب أو الذرات المنتشرة في المذيب بالتجمع في مجموعات، على المستوى المجهري (زيادة تركيز المذاب في منطقة صغيرة)، والتي تصبح مستقرة في ظل ظروف التشغيل الحالية. تشكل هذه المجموعات المستقرة النوى. لذلك، تحتاج التجمعات إلى الوصول إلى حجم حرج حتى تصبح نواة مستقرة. يتم تحديد هذا الحجم الحرج بواسطة العديد من العوامل المختلفة (درجة الحرارة، التشبع الفائق، وما إلى ذلك). في مرحلة النواة تصطف الذرات أو الجزيئات بطريقة محددة ودورية تحدد البنية البلورية - لاحظ أن "البنية البلورية" هو مصطلح خاص يشير إلى النسبية ترتيب الذرات أو الجزيئات، وليس الخصائص العيانية للبلورة (الحجم والشكل)، على الرغم من أن ذلك نتيجة للبنية البلورية الداخلية.
النمو البلوري هو الزيادة اللاحقة في حجم النوى التي تنجح في تحقيق حجم الكتلة الحرج. النمو البلوري هو عملية ديناميكية تحدث في حالة توازن حيث تترسب الجزيئات أو الذرات المذابة خارج المحلول وتذوب مرة أخرى في المحلول. التشبع الفائق هو إحدى القوى الدافعة للتبلور، حيث أن قابلية ذوبان نوع ما هي عملية توازن يتم قياسها بواسطة Ksp. اعتمادًا على الظروف، قد يكون التنوي أو النمو هو السائد على الآخر، مما يحدد حجم البلورة.
تتمتع العديد من المركبات بالقدرة على التبلور، حيث يمتلك بعضها هياكل بلورية مختلفة، وهي ظاهرة تسمى تعدد الأشكال. قد تكون بعض الأشكال المتعددة شبه مستقرة، مما يعني أنه على الرغم من أنها ليست في حالة توازن ديناميكي حراري، إلا أنها مستقرة حركيًا وتتطلب بعض مدخلات الطاقة لبدء التحول إلى مرحلة التوازن. جميع متعددات الأشكال هيفي الواقع حالة ديناميكية حرارية صلبة مختلفة وتظهر الأشكال البلورية لنفس المركب خواص فيزيائية مختلفة، مثل معدل الذوبان، والشكل (الزوايا بين الأوجه ومعدلات نمو الأوجه)، ونقطة الانصهار، وما إلى ذلك. لهذا السبب يعد تعدد الأشكال ذا أهمية كبيرة في التصنيع الصناعي للمنتجات البلورية. بالإضافة إلى ذلك، يمكن في بعض الأحيان تحويل المراحل البلورية من خلال عوامل مختلفة مثل درجة الحرارة، كما هو الحال في تحويل الأناتاز إلى روتيل من ثاني أكسيد التيتانيوم.
في الطبيعة


نشاهد في الطبيعة ظواهر كثيرة تتضمن عملية التبلور، وفي كثير من الأحيان تكون عصوراً جيولوجية طويلة قد مضت حتى تتكون، مثل:
- المعادن الخام والصخور مثل الجرانيت متبلورة بطبيعتها، وكذلك الأحجار الكريمة،
- متدليات الكهوف وصواعد الكهوف وهي أعمدة مخروطية متبلورة تحتوي على الماء. وعادة تتواجدا سوياً ، حيث تتكون المتدليات أو الهوابط من تتابع تساقط قطرات الماء المحتوية على تركيبات معدنية ذائبة فيتبخر الماء منها وتعلق التركيبات المعدنية وتتبلور في هيئة المتدليات من أسقف الكهوف. عند سقوط قطرات الماء من المتدليات تشكل أيضا علي أرضية الكهف بعد تبخرها مخروطات هرمية من تركيبات المعادن المتبلورة ، ومع مرور الزمن تستطيل المتدليات من أعلى إلى أسفل بينما يتزايد ارتفاع الصواعد المخروطية تحتها من أسفل إلى أعلى. بذلك يتكون الشكل المألوف للهوابط والصواعد المتبلورة في الكهوف. تحتاج نشأة تلك الأشكال البلورية إلى أزمنة طويلة من تتابع سقوط قطرات المياه المعدنية واحدة تلو الأخرى وتبلور المعادن التي يحتويها الماء تقاس بعشرات الآلاف أو مئات الآلاف من السنين.
ومن الأشكال المعهودة التي تتبلور خلال وقت قصير :
- أشكال الثليج السداسية الشكل والتي تتكون على الأسطح المستوية الباردة في وجود بخار الماء.
- تبلور عسل النحل، وتميل معظم أنواع عسل النحل على التبلور.
طرق اصطناعية
هناك طريقين لنشوء البلورات صناعياً
الطريق الأول
بتحول المادة من شكلها السائل (المصهور) إلى الصلب وذلك بانخفاض درجة الحرارة إلى ما دون درجة الانصهار
الطريق الثاني
بتغيير الشروط المحيطة بالمحل والمادة المنحلة (تحت درجة حرارة ثابتة وضغط ثابت) فتتحول المادة المنحلة إلى بلورات.
- لكل مادة منحلة solute كمية عظمى يمكن أن تنحل ضمن سائل معين والذي يدعى محل solvent ، وتدعى هذه الحالة بالمحلول المشبع.
ولكي تتشكل البلورات ضمن السائل يجب أن تتواجد بكمية تفوق تركيز المحلول المشبع ، وهو ما يدعى بالمحلول فوق المشبع.
وبعد أن يتحول المحلول إلى محلول فوق مشبع تبدأ البلورات بالتشكل حتى يعود المحلول إلى حالة الإشباع.
ولتحقيق هذه العملية لدينا ثلاث خيارات :
1- تبخير المحل ، فيزيد تركيز المادة المنحلة مما يجعلها تتبلور وتترسب.
2- تبريد المحل ، فيصبح أقل قدرة على حل المواد مما يجعلها تتبلور وتترسب أيضاً.
3- إضافة محل آخر يمتزج مع المحل الأصلي ولا يحل المادة المنحلة ، فعندما يمتزج مع المحل الأساسي تقل كمية المحل المطلوب لحل المواد فتتبلور المادة المنحلة.
تستخدم عملية البلورة الصناعية كثيراً في الصناعة الداوئية حيث تتم بلورة العديد من الأدوية بإضافة الماء إلى محلول المادة الدوائية في الإيتانول ، وذلك إذا كانت المادة لا تنحل بالماء وتنحل بسهولة في الإيتانول.
فإذا كان محلول المادة الدوائية في الإيتانول قريباً من درجة الإشباع فإن إضافة الماء إليه ستجعل المحلول في حالة فوق الإشباع وتترسب المادة الدوائية على شكل بلورات.
وباختلاف الطريق الذي سلكته البلورة يتغير ترتيب الذرات فيها مما يغير من خواصها الفيزيائية كدرجة الانصهار والانحلالية والكثافة .... الخ.
نظرة ديناميكية حرارية

تعتمد عملية التبلور على الديناميكا الحرارية وحركة الجزيئات مما يجعل من الصعب التحكم في تلك العملية. وتدخل فيها مسألة نقاوة المادة المتبلورة، وطريقة خلط المكونات، وتصميم بوتقة التبلور، وخطة التبريد، كل تلك العوامل تؤثر على حجم البلورة المتكونة، وعدد البلورات، وشكلها.
ويمكننا تصور عملية التبلور بتخهيل جزيئ في داخل "بلورة مثالية" عندما ترفع درجة حرارتها بواسطة مصدر حراري خارجي. فعند وصول البلورة إلى درجة حرارة معينة (مميزة لمادة البلورة)، ينق الرباط بين الجزيئ وما حولة فجأة ، ولحظيا يحدث ذلك لجميع الجزيئات في البلورة فتنفصل الجزئيات عن بعضها وتفقد هيكلها البلوري مكونة سائلا (يصبح توزيع مجموع الجزيئات عشوائيا لا شكل داخليا له). وتصف الديناميكا الحرارية تلك العملية بأن تحول المادة الصلبة المتبلورة إلى السيولة بسبب زيادة الإنتروبية S حيث تزيد عشوائية توزيع الجزيئات في النظام، وتغلبه على الإنثالبية H، أي قوي الروابط بين الجزيئات.
G تسمى طاقة گيبس الحرة وهي في السائل أقل من مقدارها في المادة الصلبة أو البلورة.
تلك العملية تحدث دائماً عند ارتفاع درجة الحرارة. كذلك بالنسبة إلى عملية التبريد، فبعد التبريد ووصول درجة الحرارة المميزة للمادة، فجأة تتشابك الجزيئات وتتخذ شكلها البلوري. بذلك تنخفض الأنتروبية بسبب تبوء الجزيئات أماكن ثابتة منتظمة في البلورة. وهي عندما تترابط فيما بينها فهي تطلق حرارة الارتباط إلى الجو المحيط بها الذي يزيد من عشوائية الذرات والجزيئات في الكون - أي تزيد انتروبية الكون.
ولكن السوائل التي تتصرف بهذه الطريقة عند تبريدها قليلة، فعلى الرغم من القانون الثاني للديناميكا الحرارية يحدث التبلور عادة عند درجة حرارة أقل قليلا عن درجة الحرارة المميزة للمادة - عند حالة للسائل تسمي "تبريد فائق". وهذا يعني من وجهة النظر الديناميكية الحرارية أنه من الأسهل هدم البلورة وتفرقة جزيئاتها عن جمعهم وبناء النظام البلوري.
وإنه من الأسهل إذابة بلورة في مذيب عن تكوين بلورة منتظمة من هثل ذلك المحلول. إن تكوين نواة ابتدائية للتبلور وتنمية البلورة يعتمد على التحكم في حركة الجزيئات أكثر من اعتماده على التحكم في الحركة الحرارية (الديناميكا الحرارية).
الديناميكا
كما ورد أعلاه، تتشكل البلورة وفقًا لنمط أو بنية محددة جيدًا، تمليها القوى المؤثرة على المستوى الجزيئي. نتيجة لذلك، أثناء عملية تكونها، تكون البلورة في بيئة يصل فيها تركيز المذاب إلى قيمة حرجة معينة، قبل تغيير الحالة. يمكن أن يحدث تكوين المادة الصلبة، المستحيل تحت عتبة [ذوبان|[الذوبان]] عند ضغط ودرجة حرارة معينة، عند تركيز أعلى من مستوى الذوبان النظري. الفرق بين القيمة الفعلية لتركيز المذاب عند حد التبلور وعتبة الذوبان النظرية (الثابتة) يسمى التشبع الفائق وهو عامل أساسي في التبلور.
التنوي
التنوي هو بدء تغيير الطور في منطقة صغيرة، مثل تشكل بلورة صلبة من محلول سائل. ويحدث نتيجة للتقلبات المحلية السريعة على المستوى الجزيئي في مرحلة متجانسة تكون في حالة توازن شبه مستقر. إجمالي النواة هو مجموع تأثير فئتين من التنوي – الرئيسي والثانوي.
التنوي الرئيسي
التنوي الرئيسي هو التشكل الأولي للبلورة حيث لا توجد بلورات أخرى أو حيث، إذا كانت هناك بلورات موجودة في النظام، ليس لها أي تأثير على العملية. يمكن أن يحدث هذا في حالتين. الأولى هي التنوي المتجانس، وهو التنوي الذي لا يتأثر بأي شكل من الأشكال بالمواد الصلبة. وتشمل هذه المواد الصلبة جدران وعاء التبلور وجزيئات أي مادة غريبة. الحالة الثانية إذن هي التنوي غير المتجانس. ويحدث هذا عندما تتسبب الجزيئات الصلبة للمواد الأجنبية في زيادة معدل التنوي الذي لا يمكن رؤيته بدون وجود هذه الجزيئات الأجنبية. نادرًا ما يحدث التنوي المتجانس في الممارسة العملية بسبب الطاقة العالية اللازمة لبدء التنوي دون وجود سطح صلب لتحفيز التنوي.
يحدث التنوي الرئيسي (المتجانس وغير المتجانس) على النحو التالي:[1]
حيث
- B هو رقمية النوية المشكلة لكل وحدة حجم لكل وحدة زمن،
- N هو رقم النوية لكل وحدة حجم،
- kn هو ثابت المعدل،
- c هو تركيز المذاب اللحظي،
- c* هو تركيز المذاب عند التشبع،
- (c − c*) يُعرف ايضاً بالتشبع الفائق،
- n هو أس تجريبي يمكن أن يصل حجمه إلى 10، ولكنه يتراوح عمومًا بين 3 و4.
التنوّي الثانوي
التنوي الثانوي هو تشكل نوى يعزى إلى تأثير البلورات المجهرية الموجودة في الصهارة.[2] ببساطة، يحدث التنوي الثانوي عندما يبدأ نمو البلورات عن طريق ملامسة بلورات أو "بذور" أخرى موجودة.[3] يُعزى النوع الأول من التبلور الثانوي المعروف إلى قص السوائل، ويعزى النوع الآخر إلى الاصطدامات بين البلورات الموجودة بالفعل إما مع السطح الصلب للمتبلور أو مع بلورات أخرى نفسها. يحدث تنوي قص السوائل عندما ينتقل السائل عبر البلورة بسرعة عالية، ويجرف النوى التي كان من الممكن دمجها في البلورة، مما يتسبب في تحول النوى التي تم جرفها إلى بلورات جديدة. لقد وجد أن التنوي التماسي هو الطريقة الأكثر فعالية وشائعة للتنوي. تشمل الفوائد ما يلي:[2]
- النظام الحركي المنخفض والمعدل المتناسب مع التشبع الفائق، مما يسمح بالتحكم السهل دون تشغيل غير مستقر.
- يحدث عند التشبع الفائق المنخفض، حيث يكون معدل النمو مثاليًا للجودة المثلى.
- انخفاض الطاقة اللازمة التي تضرب بها البلورات لتجنب تكسير البلورات الموجودة إلى بلورات جديدة.
- يتم بالفعل عزل الأساسيات الكمية ويجري دمجها في الممارسة العملية.
النموذج التالي، على الرغم من تبسيطه إلى حد ما، غالباً ما يستخدم لنمذجة التنوي الثانوي:[1]
حيث
- k1 هو ثابت المعدل،
- MT هي كثافة المعلق،
- j هو أس تجريبي يمكن أن يصل إلى 1.5، لكن قيمته بشكل عام 1،
- b هو الأس التجريبي الذي يمكن أن يصل إلى 5، لكن قيمته بشكل عام 2.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
النمو
بمجرد تشكل البلورة الصغيرة الأولى، النواة، تعمل كنقطة التقاء (إذا كانت غير مستقرة بسبب التشبع الفائق) لجزيئات المذابة التي تلامس - أو تجاور - البلورة بحيث يزيد بُعدها في الطبقات المتعاقبة. ويشبه نمط النمو حلقات البصلة، كما هو موضح في الصورة، حيث يشير كل لون إلى نفس كتلة المادة المذابة؛ تخلق هذه الكتلة طبقات رقيقة بشكل متزايد بسبب زيادة مساحة سطح البلورة المتنامية. تسمى الكتلة المذابة المفرطة التشبع التي يمكن للنواة الأصلية "التقاطها" في وحدة زمنية "معدل النمو" معبرًا عنه بالكيلو جرام/(م2*س)، وهو ثابت خاص بـ العملية. يتأثر معدل النمو بعدة عوامل فيزيائية، مثل التوتر السطحي للمحلول، الضغط، درجة الحرارة، سرعة البلورة النسبية للمحلول، رقم رينولدز، وهكذا.
وبالتالي فإن القيم الرئيسية التي يجب التحكم فيها هي:
- قيمة التشبع الفائق، كمؤشر لكمية المادة المذابة المتاحة لنمو البلورة؛
- إجمالي سطح البلورة بوحدة كتلة السائل، كمؤشر لقدرة المذاب على التثبيت على البلورة؛
- زمن الاحتفاظ، كمؤشر لاحتمالية ملامسة جزيء المادة المذابة لبلورة موجودة؛
- نمط التدفق، مرة أخرى كمؤشر لاحتمالية تلامس جزيء من المذاب مع بلورة موجودة (أعلى في التدفق الصفحي، أقل في التدفق المضطرب، ولكن العكس ينطبق على الاحتمال من الاتصال).
القيمة الأولى هي نتيجة للخصائص الفيزيائية للمحلول، في حين تحدد القيمة الأخرى الفرق بين المبلور الجيد والمبلور سيئ التصميم.
التوزع الحجمي
إن مظهر وحجم المنتج البلوري هام للغاية في عملية التبلور. إذا كان هناك حاجة لمزيد من المعالجة للبلورات، فإن البلورات الكبيرة ذات الحجم الموحد تكون مهمة للغسيل والترشيح والنقل والتخزين، لأن تصفية البلورات الكبيرة من المحلول أسهل من تصفية البلورات الصغيرة. أيضًا، البلورات الأكبر حجمًا لها مساحة سطح أصغر إلى نسبة الحجم، مما يؤدي إلى درجة نقاء أعلى. يرجع هذا النقاء العالي إلى انخفاض احتباس السائل الأم الذي يحتوي على شوائب، وفقدان أقل في المحصول عند غسل البلورات لإزالة السائل الأم. في حالات خاصة، على سبيل المثال أثناء تصنيع الأدوية في صناعة الأدوية، غالبًا ما تكون الأحجام البلورية الصغيرة مرغوبة لتحسين معدل انحلال الدواء والتوافر الحيوي. يمكن تقدير توزيع الحجم البلوري النظري كدالة لظروف التشغيل من خلال عملية رياضية معقدة إلى حد ما تسمى نظرية التوازن السكاني (باستخدام معدلات التوازن السكاني).
عمليات التبلور الرئيسية

ومن العوامل الهامة التي تؤثر على الذوبان هي:
- التركيز
- درجة حرارة
- تكوين خليط المذيبات
- القطبية
- القوة الأيونية
لذلك يمكن تحديد عائلتين رئيسيتين لعمليات التبلور:
- تبلور التبريد
- التبلور بالتبخر
هذا التقسيم ليس واضحًا تمامًا، حيث توجد أنظمة هجينة، حيث يتم التبريد من خلال التبخر، وبالتالي الحصول في نفس الوقت على تركيز المحلول.
عملية التبلور التي يُشار إليها غالبًا في الهندسة الكيميائية هي التبلور الجزئي. هذه ليست عملية مختلفة، بل هي تطبيق خاص لأحد نظامي التبلور السابقة (أو كليهما).
تبلور التبريد
التطبيقات
معظم المركبات الكيميائية، الذائبة في معظم المذيبات، تظهر ما يسمى بالذوبان المباشر، أي أن عتبة الذوبان تزداد مع درجة الحرارة.
لذلك، كلما كانت الظروف مواتية، ينتج تشكل البلورات عن طريق تبريد المحلول ببساطة. "التبريد" هنا هو مصطلح نسبي: بلورات الأوستينيت على شكل صُلب تزيد درجة حرارتها عن 1000 درجة مئوية. مثال على عملية التبلور هذه هو إنتاج ملح گلوبر، وهو شكل بلوري من كبريتات الصوديوم. في الرسم البياني، حيث تكون درجة حرارة التوازن على المحور السيني وتركيز التوازن (كنسبة مئوية من كتلة المذاب في المحلول المشبع) في المحور الصادي، فمن الواضح أن الكبريتات تنخفض قابلية الذوبان بسرعة إلى أقل من 32.5 درجة مئوية. بافتراض وجود محلول مشبع عند 30 درجة مئوية، عن طريق تبريده إلى 0 درجة مئوية (لاحظ أن هذا ممكن بفضل انخفاض نقطة التجمد)، يحدث ترسيب كتلة من الكبريتات يتوافق مع التغير في قابلية الذوبان من 29% (قيمة التوازن عند 30 درجة مئوية) إلى حوالي 4.5% (عند 0 درجة مئوية) - في الواقع يتم ترسيب كتلة بلورية أكبر، حيث أن الكبريتات تؤدي إلى ترطيب الإماهة، وهذا له الآثار الجانبية لزيادة التركيز النهائي.
هناك قيود في استخدام تبلور التبريد:
- تترسب العديد من المواد المذابة على شكل هيدرات عند درجات حرارة منخفضة: في المثال السابق هذا مقبول، بل ومفيد، ولكنه قد يكون ضارًا، على سبيل المثال، عندما تكون كتلة الماء من الماء للوصول إلى شكل تبلور الهيدرات المستقر أكبر من الماء المتوفر: سيتم تشكيل كتلة واحدة من مذاب الهيدرات - ويحدث هذا في حالة كلوريد الكالسيوم)؛
- سيحدث الحد الأقصى من التشبع الفائق في أبرد النقاط. قد تكون هذه بمثابة أنابيب المبادل الحراري الحساسة للتقشير، وقد يُقلل التبادل الحراري بشكل كبير أو إيقافه؛
- عادة ما يعني انخفاض درجة الحرارة زيادة في لزوجة المحلول. قد تؤدي اللزوجة العالية جدًا إلى مشاكل هيدروليكية، وقد يؤثر التدفق الصفحي الناتج على ديناميكيات التبلور.
- لا ينطبق هذا على المركبات ذات الذوبان "العكسي"، وهو مصطلح يشير إلى أن الذوبان يزداد مع انخفاض درجة الحرارة (يحدث مثال مع كبريتات الصوديوم حيث يُعكس الذوبان فوق 32.5 درجة مئوية).
مُبلورات التبريد
أبسط بلورات التبريد هي خزانات مزودة بخلاط للتدوير الداخلي، حيث يتم خفض درجة الحرارة عن طريق التبادل الحراري مع سائل وسيط يدور في الغلاف. تُستخدم هذه الآلات البسيطة في العمليات المجمعة، كما هو الحال في معالجة المستحضرات الصيدلانية وتكون عرضة للتحجيم. عادةً ما توفر العمليات المجمعة جودة متغيرة نسبيًا للمنتج مع الدفعة.
مُبلور سوينسون-ووكر هو نموذج صممته شركة سوينسون على وجه التحديد حوالي عام 1920، ويحتوي على حوض مجوف أفقي نصف أسطواني يوجد فيه ناقل برغي مجوف أو بعض الأقراص المجوفة، حيث يتم تدوير سائل التبريد أثناء الدوران على المحور الطولي. في بعض الأحيان يتم أيضًا توزيع سائل التبريد في غلاف حول الحوض الصغير. تترسب البلورات على الأسطح الباردة للبراغي/الأقراص، والتي تزال منها بواسطة الكاشطات وتستقر في قاع الحوض. يقوم البرغي، إذا كان متوفرًا، بدفع الملاط نحو منفذ التفريغ.
من الممارسات الشائعة تبريد المحاليل عن طريق التبخر الومضي: عند نقل سائل عند درجة حرارة معينة T0 في غرفة عند ضغط P1 بحيث يصبح تشبع السائل درجة الحرارة T1 عند P1 أقل من T0، سيطلق السائل حرارة وفقًا لفرق درجة الحرارة وكمية المذيب، الذي يساوي إجمالي للحرارة الكامنة للتبخر الفرق في المحتوى الحراري. وبعبارة بسيطة، يتم تبريد السائل عن طريق تبخير جزء منه.
في صناعة السكر، تستخدم مبلورات التبريد العمودي لاستنفاد دبس السكر في مرحلة التبلور الأخيرة أسفل المقالي المفرغة، قبل الطرد المركزي. تدخل الكتلة إلى المبلورات في الأعلى، وتُضخ مياه التبريد من خلال الأنابيب في اتجاه معاكس.
التبلور بالتبخر
ثمة خيار آخر هو الحصول، عند درجة حرارة ثابتة تقريباً، على ترسيب البلورات عن طريق زيادة تركيز المذاب فوق عتبة الذوبان. للحصول على ذلك، يتم زيادة نسبة كتلة المذاب إلى المذيب باستخدام تقنية التبخر. هذه العملية غير حساسة للتغير في درجة الحرارة (طالما ظلت حالة الإماهة دون تغيير).
مبلورات البخر
معظم المبلورات الصناعية هي من النوع التبخري، مثل وحدات كلوريد الصوديوم والسكروز الكبيرة جداً، والتي يشكل إنتاجها أكثر من 50% من إجمالي الإنتاج العالمي من البلورات. النوع الأكثر شيوعًا هو نموذج "التدوير القسري" (FC) (انظر المبخر). جهاز ضخ (مضخة أو خلاط تدفق محوري) يحافظ على ردغة البلورة متجانس في معلق بجميع أنحاء الخزان، بما في ذلك أسطح التبادل من خلال التحكم في تدفق المضخة، يتم التحكم في وقت تلامس الكتلة البلورية مع المحلول فائق التشبع، جنبًا إلى جنب مع سرعات معقولة على أسطح التبادل. إن Oslo، المذكورة أعلاه، عبارة عن تكرير لمبلور التدوير القسري التبخيري، المجهز الآن بمنطقة ترسيب بلورات كبيرة لزيادة وقت الاحتفاظ (عادةً ما يكون منخفضًا في FC) ولفصل مناطق الردغة الثقيلة تقريبًا عن السائل الصافي. تميل البلورات التبخر إلى إنتاج متوسط حجم بلوري أكبر وتضيق منحنى توزيع حجم البلورات.[4]
مُبلوِر DTB
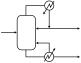
أيًا كان شكل المُبلور، لتحقيق تحكم فعال في العملية، فمن المهم التحكم في وقت الاستبقاء والكتلة البلورية، للحصول على الظروف المثلى من حيث السطح البلوري المحدد وأسرع نمو ممكن. ويتحقق ذلك عن طريق فصل البلورات عن الكتلة السائلة، من أجل إدارة التدفقين بطريقة مختلفة. الطريقة العملية هي إجراء عملية رسوب الجاذبية للتمكن من استخلاص (وربما إعادة تدوير بشكل منفصل) السائل الصافي (تقريبًا)، مع إدارة تدفق الكتلة حول المُبلور للحصول على كثافة ملاط دقيقة في مكان آخر. ومن الأمثلة النموذجية على ذلك مُبلور DTB ("أنبوب التصريف والحاجز")، وهي فكرة لريتشارد تشيزوم بنت (مهندس في سوينسون ورئيس الشركة لاحقًا) في نهاية الخمسينيات. يحتوي مُبلوِر DTB (انظر الصور) على جهاز تدوير داخلي، عادةً ما يكون خلاط تدفق محوري - أصفر - يدفع لأعلى في أنبوب التصريف بينما يوجد خارج جهاز التبلور منطقة ترسيب في الحلقة؛ حيث يتحرك محلول العادم للأعلى بسرعة منخفضة جدًا، بحيث تستقر البلورات الكبيرة - وتعود إلى الدورة الدموية الرئيسية - بينما تستخرج الحبيبات الدقيقة فقط، التي يقل حجمها عن حجم حبيبي معين، وتُدمر في النهاية عن طريق زيادة أو خفض درجة الحرارة، وبالتالي خلق المزيد التشبع. يتم تحقيق تحكم شبه مثالي في جميع المعلمات حيث توفر مُبلوِرات DTF تحكمًا فائقًا في حجم البلورة وخصائصها.[5] يمكن أن يكون المُبلور هذا والنماذج المشتقة منه (كريسال، CSC، وغيره) هو الحل النهائي لولا وجود قيود كبيرة على قدرة التبخر، نظرًا للقطر المحدود لرأس البخار والتدوير الخارجي المنخفض نسبيًا الذي لا يسمح بكميات كبيرة من الطاقة التي سيتم توفيرها للنظام.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
- Abnormal grain growth
- Chiral resolution by crystallization
- سحنة بلورية
- بنية بلورية
- Crystallite
- تبلور جزئي (كيمياء)
- فيزياء الزجاج
- Igneous differentiation
- Laser heated pedestal growth
- Micro-pulling-down
- تبلور الپروتين
- تكنولوجيا الجليد القابل للضغط
- شبه بلورة
- اعادة التبلور
- إعادة التبلور (كيمياء)
- إعادة التبلور (تعدين)
- بلورة بذرة
- بلورة أحادية
- Symplectite
- تزجيج
- دراسة البلورات بالأشعة السينية
معرض الصور
- إعادة بلورة المذيب
- بلورات الأشعة السينية
المصادر
- ^ أ ب Tavare, N. S. (1995). Industrial Crystallization. Plenum Press, New York.قالب:Page?
- ^ أ ب McCabe & Smith (2000). Unit Operations of Chemical Engineering. McGraw-Hill, New York.قالب:Page?
- ^ "Crystallization". www.reciprocalnet.org. Archived from the original on 2016-11-27. Retrieved 2017-01-03.
- ^ "Submerge Circulating Crystallizers". Thermal Kinetics Engineering, PLLC (in الإنجليزية الأمريكية). Retrieved 2017-01-03.
- ^ "Draft Tube Baffle (DTB) Crystallizer". Swenson Technology (in الإنجليزية الأمريكية). Archived from the original on 2016-09-25. Retrieved 2023-11-15.
قراءات إضافية
- Glynn P.D. and Reardon E.J. (1990) "Solid-solution aqueous-solution equilibria: thermodynamic theory and representation". Amer. J. Sci. 290, 164-201.
- Geankoplis, C.J. (2003) "Transport Processes and Separation Process Principles". 4th Ed. Prentice-Hall Inc.
- Stanley SJ. (2006) Tomographic imaging during reactive precipitation: mixing with chemical reaction, Chemical Engineering Science, 61 (23), pp 7850-7863
- Aulton's Pharmaceutics
- "Small Molecule Crystallization" (PDF) at Illinois Institute of Technology website
- Arkenbout-de Vroome, Tine (1995). Melt Crystallization Technology CRC ISBN 1-56676-181-6
- Geankoplis, C.J. (2003) "Transport Processes and Separation Process Principles". 4th Ed. Prentice-Hall Inc.
- Glynn P.D. and Reardon E.J. (1990) "Solid-solution aqueous-solution equilibria: thermodynamic theory and representation". Amer. J. Sci. 290, 164–201.
- Jancic, S. J.; Grootscholten, P.A.M.: “Industrial Crystallization”, Textbook, Delft University Press and Reidel Publishing Company, Delft, The Netherlands, 1984.
- Mersmann, A. (2001) Crystallization Technology Handbook CRC; 2nd ed. ISBN 0-8247-0528-9
وصلات خارجية