فوسفات
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك النظامي
Phosphate[1] | |||
| Identifiers | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| مرجع بايلستاين | 3903772 | ||
| ChEBI | |||
| ChemSpider | |||
| مرجع Gmelin | 1997 | ||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| UNII | |||
| InChI | InChI={{{value}}} | ||
| SMILES | |||
| الخصائص | |||
| الصيغة الجزيئية | PO3−4 | ||
| كتلة مولية | 94.9714 g mol−1 | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الفوسفات (إنگليزية: phosphate)، في الكيمياء غير العضوية هو ملح لحمض الفوسفوريك. وفي الكيمياء العضوية فالفوسفات أو الفوسفات العضوي إنگليزية: Organophosphate هو استر لحمض الفوسفوريك. والفوسفات له أهمية كبيرة في الكيمياء الحيوية وكيمياء الأرض الحيوية إنگليزية: Biogeochemistry. وهو أحد الثروات المعدنية للعالم الإسلامي وخاصةالمغرب ومصر والأردن وفلسطين.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص الكيميائية
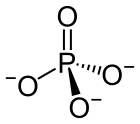
أيون الفوسفات هو أيون متعدد الذرات وصيغته المجملة PO43− وكتلته المولية of 94.973 گ/مول؛ ويتكون من ذرة فوسفور واحدة مركزية يحيط بها أربع ذرات متشابهة من الاكسجين في ترتيب على شكل منشور رباعي tetrahedron . ويحمل أيون الفوسفات شحنة صيغية سالبة مقدارها ناقص ثلاثة، وهو قاعدة مرافقة لأيون فوسفات الهيدروجينHPO42−، الذي يعتبر قاعدة مرافقة لأيون الفوسفات ثنائي الهيدروجين H2PO4−، والذي بدوره هو القاعدة المرافقة لحمض الفوسفوريك H3PO4. وهو جزيء مفرط التكافؤ (ذرة الفوسفور لديها 10 إلكترونات في غلاف تكافؤها). الفوسفات هو أيضاً مركب فوسفور عضوي صيغته OP(OR)/* خصائص كيميائية */ 3
ويتكون ملح الفوسفات عندما يلتحم أيون موجب بذرات أكسجين ذات الشحنة السالبة في الأيون، مشكلين مركباً أيونياً. والعديد من الفوسفاتات هم غير قابلين للذوبان في الماء عند درجة الحرارة والضغط القياسيان.
التوازن في المحلول
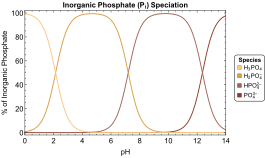
في المحاليل المائية، يتواجد حمض الفوسفوريك وأنيوناته الثلاثة المشتقة وفقًا لتوازن التفكك وإعادة التركيب كما هو موضح أدناه:[2]
| التوازن | ثابت التفكك Ka[3] | pKa |
|---|---|---|
| H3PO4 |
Ka1 = [ H+ ] [ H 2PO−4 ] / [ H 3PO 4 ] ≈ 7.5 × 10−3 | pKa1 = 2.14 |
| H 2PO−4 |
Ka2 = [ H+ ] [ HPO2−4 ] / [ H 2PO−4 ] ≈ 6.2 × 10−8 | pKa2 = 7.20 |
| HPO2−4 |
Ka3 = [ H+ ] [ PO3−4 ] / [ HPO2−4 ] ≈ 2.14 × 10−13 | pKa3 = 12.37 |
الكيمياء الحيوية للفوسفات
في النظم الحيوية، قد يتواجد الفسفور على شكل أنيونات فوسفات حرة في المحلول (الفوسفات الغير عضوي) أو مرتبطاً بجزيئات عضوية متنوعة على شكل مركبات مختلفة من الفوسفات العضوي.
بصفة عامة، يشار إلى الفوسفات الغير عضوي Pi، وعلى المستوى الفسيولوجي (التماثل الساكن) يتكون درجة الحموضة يتكون في الأساس من خليط من أيونات [HPO 4]2− و[H 2PO 4]− . عند درجات الحموضة المحايدة،كما في العصارة الخلوية (pH = 7.0)، تكون نسب تركيزات حمض الفوسفوريك وأنيوناته الثلاثة كالتالي:
- [ H 2PO−4 ] / [ H 3PO 4 ] ≈ 7.5 × 104
- [ HPO2−4 ] / [ H 2PO−4 ] ≈ 0.62
- [ PO3−4 ] / [ HPO2−4 ] ≈ 2.14 × 10−6
العظام والأسنان
أحد التواجدات الهامة للفوسفات في النظم الحيوية هو المادة الهيكلية للعظام والأسنان. هذه الهياكل مصنوعة من فوسفات الكالسيوم في شكل هيدروكسيپاتيت. تتكون مينا أسنان الثدييات من الفلوروأپاتيت، هيدروكسي فوسفات الكالسيوم حيث أستبدلت بعض مجموعات الهيدروكسيل بأيونات الفلوريد.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
أيض النبات
تمتص النباتات الفسفور من خلال عدة مسارات: مسار جذيري-شجري ومسار الامتصاص المباشر.
الآثار الصحية الجانبية
يرتبط فرط فوسفات الدم، أو ارتفاع مستوى الفوسفات في الدم، بارتفاع معدل الوفيات في عموم السكان. يحدث فرط فوسفات الدم بشكل عام بسبب الفوسفات الإضافات الغذائية التي تحتوي على الفوسفات، أي الفوسفات الذي يضاف إلى مستحضرات الطعام، حيث لا يتمص الفوسفات الموجود بشكل طبيعي في الطعام تمامًا بواسطة الجهاز الهضمي. يحفز الفوسفات تكلس الأوعية الدموية، ووجد أن التركيز العالي للفوسفات في الدم يكون مؤشرا على مشكلات بالقلب والأوعية الدموية.[4]
يشيع استخدام الفوسفات كمواد مضافة في الأغذية المعالجة صناعياً والوجبات السريعة. تعد الوجبات السريعة والأطعمة المصنعة الجاهزة للأكل من المساهمين الرئيسيين في زيادة استهلاك الفوسفات بين السكان. توجد أيضًا إضافات الفوسفات بشكل شائع في المشروبات الغازية المنكهة بالإضافة إلى بعض منتجات الألبان.[4]
ترتيب الاحتياطات في العالم
تمثل البلدان الثلاث الرئيسية المنتجة للفوسفات (الصين، المغرب والولايات المتحدة) حوالي 70% من الإنتاج العالمي.
| البلد | الإنتاج (مليون كگ) |
الحصة العالمية الإنتاج(%) |
الاحتياطيات (مليون كگ) |
|---|---|---|---|
| الجزائر | 1٬300 | 0.54 | 2٬200٬000 |
| أستراليا | 2٬700 | 1.17 | 1٬100٬000 |
| البرازيل | 4٬700 | 3.00 | 1٬600٬000 |
| الصين | 95٬000 | 44.83 | 3٬200٬000 |
| مصر | 5٬000 | 2.47 | 2٬800٬000 |
| فنلندا | 995 | - | 1٬000٬000 |
| الهند | 1,480 | 0.49 | 46٬000 |
| العراق | 200 | 0.09 | 430٬000 |
| إسرائيل | 2,810 | 1.48 | 57٬000 |
| الأردن | 9,220 | 3.36 | 800٬000 |
| قزخستان | 1٬500 | 0.72 | 260٬000 |
| المكسيك | 558 | 0.76 | 30٬000 |
| المغرب والصحراء الغربية | 35٬500 | 13.45 | 50٬000٬000 |
| پيرو | 4٬000 | 1.79 | 210٬000 |
| روسيا | 13٬100 | 5.60 | 600٬000 |
| السعودية | 6٬500 | 1.48 | 1٬400٬000 |
| السنغال | 3,420 | 0.45 | 50٬000 |
| جنوب أفريقيا | 2٬100 | 0.99 | 1٬400٬000 |
| سوريا | 2٬000 | 0.34 | 1٬800٬000 |
| توگو | 800 | 0.45 | 30٬000 |
| تونس | 4,110 | 1.79 | 100٬000 |
| أوزبكستان | 900 | - | 100٬000 |
| الولايات المتحدة | 23٬300 | 12.37 | 1٬000٬000 |
| ڤيتنام | 4,650 | 1.21 | 30٬000 |
| بلدان أخرى | 1,140 | 1.17 | 840٬000 |
| الإجمالي | 227٬000 | 100 | 71٬000٬000 |
الإنتاج
التواجد الجيولوجي


الفوسفات في مصر
يعتبر الفوسفات في مصر واحداً من أهم الرواسب المعدنية من الناحيتين ، التعدينية والاقتصادية ،لأن إنتاجه كان ولا يزال يشغل مكاناً بارزا في مجال التعدين. ويرجع السبب في ذلك على الانتشار الواسع لتواجد الفوسفات في مصر إذ إنه يوجد على هيئة حزام من رواسب الفوسفات يمتد إلى مسافة حوالي 750 كم طولا من ساحل البحر الأحمر شرقا على الواحات الداخلة غربا.
أما أهميته الاقتصادية فتتلخص في أنه يصدر إلى الخارج بكميات كبيرة كما يتم تصنيع جزء منه على شكل أسمدة كيميائية تصنف كنوع من السوبر فوسفات .
وتتواجد مواقع الفوسفات التي لها أهمية اقتصادية بمصر في ثلاث مناطق رئيسية هي :
- وادي النيل بين أدفو و قنا :
ومن أهم مناطق التواجد منطقتا المحاميد و السباعية وتقدر احتياطيات خام الفوسفات في منطقة المحاميد وحدها بحوالي 200 مليون طن كما تصل نسبة [خامس أكسيد الفوسفور] إلى حوالي 22% .
وقد أسفرت الدراسات الجيولوجية عن احتياطي يقدر بحوالي 1000 مليون طن بالمناطق المجاورة لمنطقة المحاميد .
- ساحل البحر الأحمر بين سفاجة والقصير :
يتواجد خام الفوسفات بين ميناء سفاجة والقصير بمناطق أهمها [جبل ضوي] ومنطقة العطشان والحمراوين وتقدر الاحتياطيات من 200 إلى 250 مليون طن من خام الفوسفات .
- الصحراء الغربية :
تمثل هضبة أبو طرطور الواقعة بين الواحات الداخلة أضخم راسب من الفوسفات في مصر حيث يقدر الاحتياطي من الخام بنحو 1000 مليون طن ، غير أنه توجد بعض العقبات التي تحول دون استغلاله الاستغلال الأمثل وذلك لوجود نسبة ملحوظة من الشوائب مما يزيد من تكلفة إنتاجه .
الفوسفات في المغرب
المغرب هو ثالث منتج عالمي للفوسفات وأول مصدر لهذه المادة إذ يتوفر على %75 من الاحتياطي العالمي الذي يتوزع بنسب متفاوتة بين أربع مناطق أساسية وهي: بن جرير و بوكراع و خريبكة و اليوسفية .
الفوسفات مادة طبيعية ، يتكون أساسا من فوسفات ثلاثي الكالسيوم 2(Ca3(PO4 وهو قليل الذوبان في الماء لذلك لا يستعمل مباشرة إلا بعد معالجته وتحسين جودته بتجفيفه وتنقيته (إزالة المواد العضوية و ثاني أكسيد الكربون وفصله عن الصلصال.
من أهم مشتقات الفوسفات الأسمدة الفوسفاتية المستعملة في الفلاحة وحمض الفوسفوريك (H3PO4).
يختزن باطن الأرض المغربية ثلثي الاحتياطي العالمي من الفوسفات. يتوزع هذا الاحتياطي بنسب متفاوتة بين أربع مناطق هي : أولاد عبدون، كنتور ، وادي الذهب و مسقلة. هذه الأخيرة لم تفتح بعد للاستغلال.
الفوسفات في الأردن
يعنبر الفوسفات واحدا من أهم المعادن الموجودة في الأردن ويتواجد في منطقة الطفيلة وفي منطقة الشيدية في معان التي يقدر الاحتياطي المؤكد من خام الفوسفات فيها بحوالي 5. 1 مليار طن.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
استخدامات الفوسفات
يستخدم الفوسفات في العديد من الصناعات الكيميائية أهمها تحضير عنصر الفسفور و حامض الفسفور ، المستعمل في الصناعات التعدينية والحربية والطبية والغذائية والخزفية والنسيج والثقاب. ويذهب معظم الفوسفات المستخرج لصناعة الأسمدة لزيادة المحاصيل الزراعية بالإضافة إلى إمكانية استخراج بعض المعادن النادرة والعناصر المشعة. ومن بين هذه العناصر يوجد اليورانيوم كمنتج جانبي الذي يمكن الحصول عليه أثناء تحويل الفوسفات إلى أسمدة أو حمض الفسفور. وتحتوى خامات الفوسفات الصحراوية على 200 جرام من اليورانيوم في الطن الواحد.
إن الاهتمام الدولي بالفوسفات أمر طبيعي ، باعتباره يدخل في جملة من الصناعات التحويلية والتي من أهمها الأسمدة الكيميائية ، مما يجعله موردا هاما يحظى بطلب متزايد من طرف أغلبية دول العالم وخصوصا تلك التي تهتم بالإنتاج الزراعي وتدافع عن أمنها الغذائي ، الذي أصبح مرتبطا إلى حد ما بقدرة البلد في الحصول على هذه الأسمدة باعتبار ذلك - كما أشرنا – عاملا لرفع كمية الإنتاج الزراعي وهذا ما يجعل الطلب على الأسمدة الكيميائية يحظى بعناية كبيرة في السوق الدولية ، ولذا ليس غريبا أن يسعى المغرب إلى الاحتكار الكلي للأسمدة الفوسفاتية التي تشكل في الظرف الحالي ما يقارب 80% من الإنتاج العالمي للأسمدة.
إن الزيادة الملحوظة في استخدام خامات [الفوسفات] يدل على أهميتها وهو ما يؤكد الحاجة الماسة في الحصول عليها ، كما يظهر من خلال ديناميكية الإنتاج العالمي للفوسفات في الفترات الزمنية الآتية (مليون طن): في 1960 تم إنتاج 42 وفي 1969 أنتجت 77، أما في 1974 انتج العالم 110 وفي سنة 1980 وصل الإنتاج إلى 132 وفي سنة 1990 تم إنتاج 162 وفي 1996 انخفض الإنتاج إلى، 133، أما في سنة 2001 وصل الإنتاج إلى 128.
من خلال هذه المعلومات يتضح أن استهلاك العالم [للفوسفات] في العقود الأربعة الأخيرة شهد ارتفاعا كبيرا، لا سيما أن الدولة التي تملك احتياطات كبيرة من هذه المادة بإمكانها التحكم في أسعار هذا المورد في السوق الدولية. وبالقطع فإن المغرب يوجد ضمن الدول المعروفة في إنتاج الفوسفات بحكم احتواء أراضيه على 45,1% من احتياط العالم للفوسفات (هذا إذا ما استثنيت احتياطات الصحراء الغربية المحتلة من طرف المغرب). وهو ما مكنه من التأثير على عدد كبير من الدول المرتبط نموها بمدى تطور الإنتاج الزراعي.
في الطعام
مادة الفوسفات المصنعة تضاف إلى كثير من أنواع الأغذية الجاهزة والمجمدة، ومن المعروف أن الفوسفات مضر للمصابين بأمراض الكلى، لكن الأطباء يحذرون حتى الأصحاء. يجهل الكثيرون مخاطر الفوسفات الذي يضاف إلى كثير من أنواع الوجبات السريعة والأغذية المحفوظة والمجمدة، مثل البيتزا الجاهزة والجبنة التي لا تحفظ في ثلاجات والمشروبات الغازية وحتى في بعض أغذية الأطفال. وللفوسفات عدة استخدامات، فهو يساعد في حفظ الأغذية أو إكسابها طعماً، كما يساعد في إعطاء منتجات الألبان قواماً أفضل، ويساعد في حفظ لون الكولا أو منع الحليب المجفف من التثاقل.
ومن المعروف منذ وقت بأن الفوسفات مضر بالنسبة للمصابين بمرض الكلى، لكن دراسة حديثة تحذر من الفوسفات المضاف والذي يسبب ارتفاع نسبة الفوسفات في الدم حتى لدى الأصحاء، ويزيد بالتالي من مخاطر الإصابة بأمراض القلب. ويقول د. ماتياس ريدل، خبير التغذية في هذا السياق: "المذهل في البيانات الجديدة هو أن الفوسفات الذي يمتصه الجسم بالتغذية يمكن أن يترك آثارا ضارة على الأصحاء، وعلى أولئك الأكثر عرضة للإصابة بتصلب الشرايين على حد سواء".
ولا يتعلق الأمر بالفوسفات الطبيعي المتوفر في العديد من المواد الغذائية، مثل اللحوم والبقوليات والمكسرات، والذي يستطيع الجسم التعامل معه بسهولة. فمعدن الفوسفور يلعب مع الكالسيوم دوراً هاماً في استقلاب العظام، ويساعد في تخزين الطاقة في الخلايا وتحقيق التوازن الحمضي القاعدي، وطريقة تعامل الجسم معه تختلف بحسب شكله.
في الأطعمة الغنية بالبروتين الطبيعي مثل منتجات الألبان، يمتص الجسم فقط نصف كمية الفوسفات، بينما الفوسفات الموجود في البقوليات والحبوب فهو موجود في شكل حمض الفيتيك والتي بالكاد يمتصه الجسم، ولذلك فالفوسفات الطبيعي غير ضار. ويوضح بروفيسور مارتن كولمان، طبيب الأمراض الباطنية الأمر قائلاً: "يقوم الجسم بامتصاص ستين في المائة فقط من الفوسفات الطبيعي، بينما يمتص الفوسفات المضاف سريعاً بشكل كامل تقريباً.[7]
وهذا الفائض من الفوسفات الذي يبقى في الدم يعمل على تغيير الجدران الداخلية للأوعية الدموية ويزيد بالتالي من احتمال الإصابة بنوبة قلبية أو سكتة دماغية، كما أنه يزيد أيضا من خطر ترقق العظام التي تصبح هشة بعد ذوبان الكالسيوم فيها. ويضيف ريدل: "نحن نعرف أنه يسرع من شيخوخة الجلد والعضلات التي نعاني منها بعد سن الثلاثين، كما يزيد من إمكانية الإصابة بتصلب الشرايين وبالتالي قد يتسبب بزيادة معدلات الوفاة بشكل كبير".
الاستخدام في الأبحاث الطبية والحيوية
النوع الطبي (الملح) من الفوسفور هو الفوسفات. تستخدم بعض أملاح الفوسفات، التي تساعد في علاج العديد من التهابات المسالك البولية، لجعل البول أكثر حمضية. كما تستخدم أيضاً لتجنب تكون حصوات الكالسيوم في المسالك البولية.[8] بالنسبة للمرضى الغير قادرين على الحصول على ما يكفي من الفوسفور في نظامهم الغذائي اليومي، عادةً بسبب بعض الاضطرابات أو الأمراض، يستخدم الفوسفات كمكمل غذائي.[8] لا يمكن التعامل مع أملاح الفوسفات القابلة للحقن، إلا من قبل مقدمي الرعاية الصحية.[8]
الفوسفات والبيئة
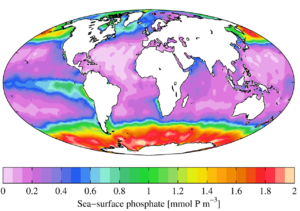
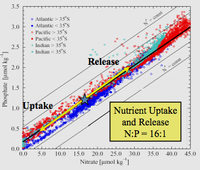
من الناحية البيئية، بسبب دورها الهام في الأنظمة الحيوية، فإن الطلب على الفوسفات كمصدر هو دوماً عالي. وبمجرد استخدامها، فإنها مادة مغذية تضع حدوداً على المواد المغذية الأخرى في البيئات، وتواجدها قد يحكم معدل نمو العضيات. وهذا صحيح عموماً في بيئات المياه العذبة، في حين يكون النيتروجين في المعتاد هو المغذي الحاد (أي الذي يحد) في البيئات البحرية (المالحة). فاضافة مستويات عالية من الفوسفات للبيئات والبيئات الصغرى، حيث تندر في المعتاد، يمكن أن يكون له عواقب بيئية كبيرة. فعلى سبيل المثال، يمكن حدوث ازدهار لمستعمرات بعض العضيات على حساب عضيات أخرى، وانهيار لمستعمرات حـُرِمت من مصادر مثل الأكسجين (انظر فرط المغذيات). وفي سياق التلوث، فإن الفوسفات هي أحد مكونات المواد كاملة الذوبان، وهو مؤشر رئيسي لجودة المياه، ولكن ليس كل الفسفور يكون في صيغة جزيئية يمكن للطحالب تكسيرها واستهلاكها.[9]
يمكن العثور على رواسب هيدروكسيأپاتيت الكالسيوم والكالسيت حول الجراثيم في أعلى التربة الطميية.[10] ولكون معادن الطمي تشجع التمعدن الحيوي، فإن تواجد الجراثيم ومعادن الطمي ينتج عنهم رواسب هيدروكسيأپاتيت الكالسيوم والكالسيت.[10]

رواسب الفوسفات يمكن أن تحتوي على كميات كبيرة من الفلزات الثقيلة المتواجدة طبيعياً. عمليات التعدين التي تعالج صخور الفوسفات يمكن أن تخلف وراءها أكواماً ذات مستويات عالية من الكادميوم والرصاص والنيكل والنحاس والكروم واليورانيوم. وما لم يـُداروا بكفاءة، فتلك النفايات يمكنها تسريب فلزات ثقيلة إلى المياه الجوفية أو المستنقعات المجاورة. فتناول النباتات والكائنات المائية لتلك المواد يمكن أن يؤدي إلى مستويات مرتفعة من فلزات عالية السمية في المواد الغذائية.[12]
ففي ألمانيا، تم إثبات أثر استخدام سماد الفوسفات المعتاد الملوث باليورانيوم في الزراعة على ارتفاع مستويات مرتفعة من اليورانيوم في مياه الشرب.[13] وفي بعض المناطق، أدى ذلك إلى توصيات بإستخدام مياه معبأة، بدلاً من مياه الصنبور، لطهي الطعام للرضع والأطفال.
انظر أيضاً
- پيروفوسفات – P2O74−
- عديد الفوسفات – PnO3n+1(n+2)−
- ميتافوسفات - PnO3nn−
- سماد
- فوسفينات – H2PO2−
- مركبات الفسفور العضوي
- فوسفات - OP(OR)3، مثل فوسفات ثلاثي الفنيل
- طلاء تحويل الفوسفات
- صودا الفوسفات، مشروب صودا فوار
- فوسفينات - OP(OR)R2
- فوسفين - PR3
- أكسيد الفوسفين - OPR3
- فوسفينيت - P(OR)R2
- فوسفونيت - P(OR)2R
- فوسفيت - P(OR)3
- فوسفونات - OP(OR)2R
- جبس الفوسفات
- فسفرة
- فوسفات ثنائي الصوديوم - Na2HPO4
- فوسفات أحادي الصوديوم - NaH2PO4
- ثلاثي عديد فوسفات الصوديوم - Na5P3O10
مرئيات
| ما هو المورد الذي سيجعل مصير العالم في يد المغرب؟ |
المصادر
- ^ "Phosphates – PubChem Public Chemical Database". The PubChem Project. USA: National Center of Biotechnology Information.
- ^ Campbell, Neil A.; Reece, Jane B. (2005). Biology (Seventh ed.). San Francisco, California: Benjamin Cummings. p. 65. ISBN 0-8053-7171-0.
- ^ Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+ , Cl−, OH−, CO2−3, SO2−4, and PO3−4 aqueous systems". Pure and Applied Chemistry, volume 77, issue 4, pages 739–800. DOI:10.1351/pac200577040739
- ^ أ ب Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K.; Mann, Johannes (January 2012). "Phosphate additives in food--a health risk". Deutsches Ärzteblatt International. 109 (4): 49–55. doi:10.3238/arztebl.2012.0049. ISSN 1866-0452. PMC 3278747. PMID 22334826.
- ^ PHOSPHATE ROCK, usgs
- ^ "On-line Objective Analyses and Statistics" (HTML/ASCII). World Ocean Atlas 2001. National Oceanographic Data Center, National Oceanographic and Atmospheric Administration. 2003.
{{cite web}}: Cite has empty unknown parameter:|coauthors=(help); Unknown parameter|accessyear=ignored (|access-date=suggested) (help) - ^ "الفوسفات – خطر مغلف في الأغذية الجاهزة". دويتش ڤيله. 2015-10-30. Retrieved 2017-12-13.
- ^ أ ب ت "Phosphate Supplement (Oral Route, Parenteral Route) Description and Brand Names - Mayo Clinic". www.mayoclinic.org. Retrieved 2020-11-20.
- ^ Hochanadel, Dave (December 10, 2010). "Limited amount of total phosphorus actually feeds algae, study finds". Lake Scientist. Retrieved June 10, 2012.
[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...
- ^ أ ب Schmittner KE, Giresse P (1999). "Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France". Sedimentology. 46 (3): 463–76. doi:10.1046/j.1365-3091.1999.00224.x.
- ^ MIREYA NAVARRO (2010-09-18). "Cleaner for the Environment, Not for the Dishes". New York Times. Retrieved 2010-09-20.
- ^ Gnandil, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (March). "The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo". Mine Water and the Environment. 25 (1): 56–62. doi:10.1007/s10230-006-0108-4.
{{cite journal}}: Check date values in:|date=and|year=/|date=mismatch (help) - ^ "Hintergründe: Uran im Dünger". www.umweltinstitut.org. Retrieved 2013-01-10.
3. "Figuring Out Phosphates," Food Product Design, June 2006, Lynn A. Kuntz
قراءات اضافية
- Schmittner Karl-Erich and Giresse Pierre, 1999. Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France. Sedimentology 46/3: 463-476.
- CS1 errors: unsupported parameter
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using div col with unknown parameters
- مركبات عضوية
- مجموعات وظيفية
- Phosphorus compounds
- Organophosphorus
- فوسفات عضوي
- فوسفات
- أوكسيأنيونات