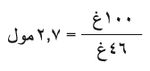فاعلية
فاعلية Efficiency تعريفاً هو نسبة الطاقة المستخدمة المفيدة Qu - مثلاً على شكل عمل- إلى الكمية الإجمالية للطاقة Q المقدَّمة للجملة (آلة ما أو محرك):
η = Qu/Q
ولعدم إمكانية التخلص من ضياع الطاقة في الاحتكاك وغيره من العمليات غير المتوازنة فإن قيمة المردود η أصغر من الواحد بالنسبة إلى الجمل الحقيقية. وعلى أساس المبدأ الثاني في الترموديناميك فإن المردود الأعظم للآلات الحرارية (نسبة العمل W الذي تبذله في دورة واحدة إلى كمية الحرارة المقدَّمة للجملة في هذه الدورة Q) يتبع فقط لدرجتي حرارة المنبعين الساخن T1 والبارد T2 ويساوي:
η = W/Q = (T1 - T2) / T1
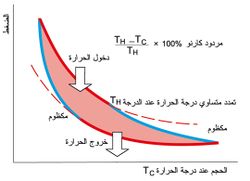
ويعرف هذا المردود بمردود دورة كارنو Carnot cycle ويعبر عن الصياغة الرياضية لمبَرْهنة كارنو Carnot theore. وتتألف دورة كارنو- كما يبيّن الشكل - من عمليتين مكظومتين adiabatic processes ومن عمليتين متساويتي درجة الحرارة isothermal processes. ويمكن النظر إلى دورة كارنو على أنها دورة المحرك الحراري الأعلى مردوداً وفقاً للقوانين الفيزيائية. وفي حين أن المبدأ الثاني في الترموديناميك يقول ليس كل الطاقة المقدمة للمحرك الحراري thermal engine يمكن أن تستخدم للقيام بعمل فإن مردود كارنو يضع القيمة الحدية لجزء الحرارة الذي يمكن أن يستخدم للقيام بعمل. وللاقتراب من مردود كارنو يتوجب على العمليات المستخدمة في المحرك الحراري أن تكون عكوسة reversible وألا تقود إلى تغير في الأنتروبية entropy. وهذا يعني أن دورة كارنو دورة مثالية لأن العمليات الفيزيائية كلها تقود إلى زيادة في الأنتروبية ولأن العمليات المستخدمة في المحركات الحقيقية والتي لاتقود إلى زيادة في الأنتروبية, غير عكوسة. كما أن دورة كارنو ليست دورة عملية للمحرك الحراري لأن انتقال الحرارة في العملية المتساوية درجة الحرارة بطيء جداً وبعيد عن أن يأخذ قيمة عملية.
وبالنسبة إلى المحركات الكهربائية فإن المردود يساوي نسبة العمل الميكانيكي المفيد إلى الطاقة الكهربائية المسحوبة من الشبكة أو من المولِّد. وفي المحولات الكهربائية يتعين المردود بنسبة الطاقة الكهرمغنطيسية التي يحصل عليها في الوشيعة الثانوية إلى الطاقة المصروفة في الوشيعة الأساسية. لمفهوم المردود طبيعة عامة، ويمكن أن يطبق على مختلف الجمل: المحركات الكهربائية electrical engines والمحركات المختلفة الأخرى والأجهزة نصف الناقلة semiconductor devices والجمل البيولوجية biological systems؛ وبالتالي يمكن استخدام مفهوم المردود لإجراء تقييم مقارن لفعالية مختلف العمليات.[1]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
مردود التفاعل
نادراً ما يكون مقدار ما يعطيه تفاعل كيمياوي من منْتَج يساوي فعلياً المقدار النظري الذي يحسب من المعادلة الكيمياوية الموازنَة لهذا التفاعل.
ويدعى مقدار المنتَج الأعظمي المردود النظري theoretical efficiency للتفاعل، وهو عادة يحسب اعتماداً على المتفاعِل المحدِّد.
ففي تفاعل الكربون مع الأكسجين المتوقع أن يكون المردودُ مولاً واحداً من ثنائي أكسيد الكربون CO2، من كل مول يُحْرَق من الكربون، وذلك على حسب المعادلة الآتية:
فإذا حرق 12 جراماً من الكربون لتحويلها إلى CO2 فإن كمية ثنائي أكسيد الكربون المتوقع تساوي مولاً من CO2 أو 44 جراماً منه، لكن ليس هذا ما يحدث عملياً، والأرجح أن تكون كمية CO2 أقل من 44 غراماً، فهي لا تزيد على 34 جراماً، ويدعى هذا المقدار المنتج الذي يعطيه التفاعل (المردود الفعلي).
مثال ثان: ما هو المردود النظري من الإتين في تفاعل إنتاجه المحفَّز بالحمض من الإيتانول إذا بدئ مثلا،، بمقدار 100 جرام من الإيتانول؟
إن المعادلة المكتوبة أعلاه موازَنَة؛ إذ يعطي مول من الإيتانول مولاً واحداً من الإتين أي بنسبة ستيوكيومترية 1: 1. أما الحمض فوق السهم فهو حفَّاز (وسيط) لا يدخل في حسابات المردود النظري.
تقوم هذه الحسابات على تعيين عدد مولات كل من المتفاعلات، وهي في هذه الحالة متفاعل وحيد هو الإيتانول. يحوَّل مقدار الـ 100 غرام منه إلى مولات، علماً أن وزن مول من الإيتانول يساوي 46غ.
ولوجود متفاعل واحد فهو أيضاً المتفاعل المحدِّد، إن العدد النظري لمولات الإتين هو 2.17 مول، وبما أن وزن المول منه 28غ فهذا يكافئ:
إذاً «المردود النظري» لهذا التفاعل يساوي 61 غراماً. تجدر الملاحظة أن المردود النظري يعبر عنه بمقدار الكتلة أو بعدد الجرامات.
مثال ثالث: يتفاعل مقدار 10 غرامات من الكحول الإيزو أميلي مع 5.22 جرام من حمض الخل ومليلتر واحد من حمض الكبريت:
يتفاعل مول واحد من الكحول مع مول واحد من حمض الخل لإعطاء مول واحد من خلات الإيزوأميل ومول واحد من الماء فالستيوكيومترية تساوي 1:1 أما الحمض المكتوب فوق السهم فهو أيضاً حفَّاز لا يدخل في حسابات المردود النظري.
فبحساب عدد مولات كلٍ من المتفاعلين:
إذاً فحمض الخل هو المتفاعل المحدِّد والعدد الأعظمي من مولات خلات الإيزوأميل التي يمكن إنتاجها يساوي 0.087 مول الذي يعطي عند التحويل إلى جرامات المردود الأعظمي للتفاعل:
لكن المقدار الفعلي المنتج يقل في الواقع عن 61 غراماً في المثال الثاني ويقل عن 11.3 جراماً في المثال الثالث.
يعزى تدني قيمة المردود الفعلي عن قيمة المردود النظري إلى العديد من الأسباب يوجز أهمها فيما يأتي:
• وجود الشوائب في المتفاعلات.
• ضياع قسم من المنتج في أثناء التداول.
• حدوث التفاعلات المنافسة أو التفاعلات الجانبية.
ففي المثال الأول الذي يتفاعل فيه الكربون مع الأكسجين لإعطاء ثنائي أكسيد الكربون يتفاعل بعض الكربون معطياً CO:
إذ لا يمكن للكربون الداخل في هذا التفاعل الجانبي تكوين CO2 ولن يعطي التفاعل نسبة 100٪ مما هو متوقع من CO2.
فإذا كان مقدار CO2 المنتج يساوي مثلاً 34 جراماً كان المردود الفعلي هو 34 جراماً وكان لمردود المئوي = 100 × 34 غ من CO2 الفعلي / 44 غ من CO2 المتوقع = 77٪
ويعرف المردود المئوي على النحو:
المردود المئوي = 100 × كتلة المنتَج الفعلية/ كتلة المنتَج المتوقعة.
وهو يستخدم قرينة للدلالة على كفاءة التفاعل.
كما أن العديد من التفاعلات الكيمياوية يبدو أنها تتوقف قبل بلوغها التمام لتعطي مزيجاً متوازناً من المتفاعلات والنواتج، كما في التفاعلات العكوسة.
فمثلاً: في التفاعل:
يكون المردود الفعلي قريباً جداً من المردود النظري لأن هذا التفاعل يمضي إلى أقصى اليمين.
أما في تفاعل:
فيكون المردود الفعلي أدنى كثيراً من المردود النظري لأن هذا التفاعل عكوس يتوقف قبل بلوغه التمام.
لتعيين المردود المئوي للتفاعل لابد من معرفة كل من المردودين النظري والفعلي له حيث يمكن حسابه بشكل آخر على النحو:
ففي تفاعل الأكسجين الذي يعطي الأوزون عند تعرضه لشرارة من قوس كهربائية يحسب المردود المئوي لهذا التفاعل الذي يعطي مثلاً جراماً واحداً من الأكسجين فيه مقدار 0.12 جرام من الأوزون على النحو الآتي:
وإذا لم تكن المتفاعلات قد مزجت بالنسبة المولية الصحيحة فإن المردود يكون محكوماً بالمتفاعِل الأقل نسبة بينها. ويحسب المردود في هذه الحالة من أجل كلٍ من المتفاعلات وتُؤخذ القيمة الأدنى على أنها المردود النظري للتفاعل.[2]
في العلوم والتكنولوجيا
في الفيزياء
في الاقتصاد
في العلوم الأخرى
انظر أيضاً
- ^ سليمان سليمان. "المردود الحراري الدينامي". الموسوعة العربية.
- ^ حسن كلاّوي. "مردود التفاعل". الموسوعة العربية.