علم البلورات

علم البلورات يختص بدراسة البلورات من حيث شكلها الظاهري أو الخارجي وتركيبها والتعرف عليها وعلى الصخور والمعادن التي تحويها. وتوجد أنواع لهذه البلورات فالصلبة منها توجد في بعض المركبات مثل NaCl ومنها السائله كما في شاشات LCD.
والأوجه البلورية في الحقيقة هي تعبير وإظهار للترتيب الذري الداخلي للمادة المتبلورة. والعملية التي تنتج لنا بلورات تعرف باسم عملية التبلور ، وهي عملية تحدث أمام أعيننا إذا تبخر ماء البحر أو المحاليل المشبعة ، أو برد مصهور ببطء أو تكثف غاز إلى الحالة الصلبة مباشرة. وفي البلاد الباردة يتجمد ماء المطر بسبب انخفاض درجة الحرارة وتتكون بلورات الثلج سداسية الشكل.
فإذا فحصنا أي بلورة منفردة من هذه البلورات الناتج نجد أن التي نمت بحرية دون عائق يحد من حريتها في النمو ، لها أسطح مستوية أو أوجه ، تكونت طبيعيا أثناء نمو البلورة. أم الأسطح التي نراها مصقولة على قطعة من الزجاج ، ومرتبة في شكل هندسي جميل ، وتباع كجواهر مقلدة ، فإنها لا نسمي أوجهها بلورية كما أن الزجاج نفسه لا يسمى بلورة ، فبالإضافة إلى أن هذه الأسطح المستوية صناعية التكوين ، فإن المادة نفسها وهي الزجاج ينقصها النباء الذري الداخلي المرتب.
ويستخدم علم البلورات الآن باستمرار وباطراد مستمر في حل كثير من المشاكل الكيميائية والفيزيائية وفي دراسات وأبحاث التعدين والمواد الحرارية والادوية والدراسات البيولوجية (الحيوية).
هناك علوم أخرى تُعنى أيضاً بدراسة الأجسام المتبلورة، كعلم الفلزات وعلم التعدين وعلم الصخور وغيرها، غير أن موضوعات هذه العلوم تتناول التجمعات البلورية crystalline aggregations، في حين يهتم علم البلورات بدراسة بنية البلورات الوحيدة monocrystals وخواصها، ولا يدرس تجمعاتها إلا من حيث نموها والتصاقاتها، وكذلك فهو يميز بين البلورات المرتبة على المستوى الذري والمواد التي لا يوجد أي ترتيب واضح لها على المستوى الذري، أي المواد اللابلورية. والمعروف أن المواد المتبلورة توجد في الطبيعة إما في حالة حبيبات منفردة أو مجموعات. ويمكن تعريف البلورة بأنها عبارة عن جسم صلب متجانس يحده أسطح مستوية تكونت بفعل عوامل طبيعية تحت ظروف مناسبة من الضغط والحرارة. والأسطح المستوية التي تحدد البلورة تعرف باسم أوجه البلورات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
النظرية
أنواع البلورات
ويمكن تقسيم البلورات حسب إستكمال الأوجه البلورية إلى ثلاثة أقسام:
1- بلورات كاملة الأوجه وذلك حينما تكون جميع الأوجه البلورية موجودة.
2- ناقصة الأوجه ، وذلك حينما يكون جزء من الأوجه متكون فقط والباقي غير موجود.
3- عديمة الأوجه ، وفي هذه الحالة يكون المادة المتبلورة عبارة عن حبيبات لا يحدها أوجه بلورية، وغالبا ما توجد هذه الحبيبات في هيئة مجموعات.
وتشترك هذه الأنواع الثلاثة (كاملة الأوجه – ناقصة الأوجه – عديمة الأوجه) ، في أن لها بناءا ذريا داخليا منتظما. أو بمعنى آخر أن المواد المكونة لها سواء أكانت ذرات أم أيونات .. توجد مرتبة في نظام هندسي. وعلى هذا الأساس يتبين لنا أنه ليس من الضروري بتاتا ان نجد الأوجه البلورية تحدأ المادة المتبلورة ، إذ أن تكون هذه الأوجه رهن بالظروف المحيطة بالمادة المتبلورة أثناء عملية التبلور. وعلى ذلك فإننا نعرف كل مادة صلبة ذات بناء ذري داخل يمنظم باسم مادة متبلورة ، فإذا كانت هذه المادة المتبلورة ذات أوجه طبيعية مرتبة في نظام هندسي ، ويمكن رؤية هذه الأوجه بواسطة العين المجدرة ، أو عدسة مكبرة ، سميت باسم بلورة.
أما إذا كانت المادة ينقسها النباء الذري الداخلي المنتظم فتوصف بأنها مادة غير متبلورة ، وتكون المعادن غير المتبلورة في المملكة المعدنية قلة (وتعتبر استثناء وليست قاعدة إذا التزمنا بالتعريف الحرفي للمعدن الذي يتضمن أن المعدة مادة متبلورة) ، ومن أمثل المعادن غير المتبلورة الأوبال Opal (SiO2. nH2O) ، والكريزوكولا Chrysocolla (سليكات النحاس المائية). ولما كان البناء الذري في مثل هذه المواد غي رالمتبولة غير منتظم فإننا نجد أن تركيبها الكيميائي غير ثابت. وبالتالي لا يعبر عنه بقانون كيميائي. فمثلا تتراوح نسبة الماء في معدن الأوبال ما بين 6 ، 9 بالمائة وقد تصل إلى 20 بالمائة من وزن المعدن. أما في معدن الكريزوكولا ، فإن تركيبه الكيميائي متغير في مدى كبير حيث نجد أن كميات النحاس والماء متغيرة وليست ثابتة.
ومن هذا يتضح لنا أن الفرق بين المادة المتبلورة وغير المتبلوة يكون في البناء الداخليز وفإذا كانت الذرات مرتبة في نظام معين فالمادة متبلورة ، أما إذا لم تكن كذلك ، أي أن الذرات غير مرتبة ، فالمادة اذن غير متبلورة. وعندما لا توجد أوجه بلورية ، فإنه لا يمكن التفرقة بين المادة المتبلورة وغير المتبلورة إلا بواسطة استعمال الميكروسكوب المستقطب وفي بعض الأحياء الأشعة السينية.
ولكن إذا كانت الأوجه البلورية موجودة ، كلها أو بعضها ، فإن دراستها تساعدنا كثيرا في التعرف على المعدن ، لأن الأوجه البلورية ، ما هي إلا تعبير عن البناء الذري الداخلي المميز للمعدن. و"موروفوروجيا البلورات" هو ذلك الفرع من علم البلورات الذي يختص بدراسة الخواص الخارجية للبلورات.
وقبل أن نصف المظهر الخارجي للبلورات بشئ من التفصيل ، يجدر بنا أن نشير إشارة سريعة إلى بعض الخواص الهندسية للبناء الذري الداخلي المنتظم للبلورات.
البناء الداخلي للبلورات
تتميز المواد المتبلورة بحقيقة أساسية هي الترتيب المنتظم للذرات والأيونات التي تتكون منها. وعلى ها الأساس يجب أن نتصور البلورة كبنيان يتكون من وحدات غاية في الدقة تتكرر بانتظام في الأبعاد الثلاثة. وأساس البناء البلوري هو التكرار ، الذي يمكن تشبيهه بتكرار رسم معين على ورق الزينة الذي يلصق على الحائط (ولكن مع فارق أنه في هذه الحالة الأخيرة يتكرر في بعدين فقط).
وتترتب هذه الوحدات المتشابهة عن نقاط منتظمة في الأبعاد الثلاثة بطريقة تجعل كل نقطة لها نفس الظروف المحيطة بالنقاط الأخرى ، وبتحديد هذا الترتيب بواسطة اتجاهاته الثلاثة والمسافات التي تتكر عندها النقاط في هذه الاتجاهات. وقد أوضحت المحاولات التي قام بها برافيه عام 1848 أن هناك 14 نمطا فقط لهذه الترتيبات ممكنة هندسيا . وتعرف هذه الترتيبات الفراغية باسم الترتيبات الفراغية الأربعة عشر لبرافبه The 14 Barvbis space lattices.
وأبسط وحدات الترتيب الفراغي مجسم متوازي السطوح ويعرف باسم الوحدات الثنائية ، ويلاحظ أن بعض هذه الترتيبات الفراغية أو الوحدات الفراغية البدائية تحتوي الواحدة منها على نقطة واحدة (وتفسير ذلك أنه بالغرم من وجود نقاط عند الأركان الثمانية للوحدة البنائية في الترتيب الفراغي البدائي. إلا أنه نظرا لأن كل نقطة من هذه النقاط تكون مشتركة بين ثماني وحدات بنائية متجاورة. فإن ثمن نقطة يتبع الوحدة البنائية الواحدة ، وبالتالي تسهم النقاط عند الأركان الثمانية بما يساوي نقطة واحدة بالنسبة للوحدة البنائية الواحدة). وتختلف هذه الوحدات البنائية البدائية عن بعضها البعض في أطوال حدودها (حوافها) والزوايا المحصورة بين هذه الحدود ((α, β, γ ، أما بقية الوحدات البنائية ، فلها نقاط إضافية إما عند مراكز جميع الأوجه . وتعرف باسم ممركز الأوجه أو عند وجهين متقالبين أو ممركزة في الداخل. وفي جميع هذه الحالات تكون الوحدة البنائية مضاعفة أي تحتوي على أكثر من نقطة (4 نقاط في حالة F ، نقطتان في كل من حالتي C , I).
وتكون الوحدات البنائية المرصوصة في ترتيب الهيكل الغرافي – ترتيب فراغي بدائي P ترتيب فراغي ممركز في الدخل 1 – البلورات التي نمسكها بين أيدينا ونجري عليها الاختبارات ومها هذه الوحدات في الحقيقة إلى ذرات أو مجموعات من الذرات. ففي البلورة كما في المعادن العنصرية (أي التي تتكون من عنصر واحد) ، نجد الذرات غير مشحونة ، ولكن في معظم الحالات تحمل الذرات شحنات كهربية ، وتعرف حينئذ باسم أيونات (تعرف الموجبة منها باسم كاتيونات بينما تعرف السالبة باسم أنيونات). وتتكون معظم المعادن من أيونات أو حشود من الأيونات يضمها إلى بعضها البعض روابط كهربائية نائية عن الشحنات المضادة ونقصد بكلمة بناء البلورة ترتيب الأيونات والمجموعات الأيونية في الفراغ وطبيعة الروابط الكهربائية التي تضم هذه الأيونات إلى بعضها البعض ، ومدى قوة هذه الروابط. ويمكن تشبيه الوحدات البنائية (الذرات والأيونات والحشود الأيونية) ، بقالب الطوب في بنيان حائط بينما تشبه الروابط الكهربية بين هذه الوحدات البنائية ، بالمونة التي تضم القوالب بعضها إلى بعض.
الخواص الخارجية للبلورات
الأوجه البلورية
إن ظهور البلورات في الطبيعة بأشكالها الهندسية كان لغزاً بدأ تفسيره العالم الروسي ميخائيل لومونوسوڤ (1711- 1765) Lomonosov، حين بَيَّن أن الشكل الهندسي الخارجي المتعدد الوجوه للبلورة ليس إلا تعبيراً وانعكاساً عن وجود ترتيب داخلي على المستوى الذري فيما سمي البنية الشبكية التي تُحدد بالأشعة السينية. وقد يمتد هذا الترتيب ليكوِّن بلورة كبيرة تظهر للعيان في سطوح صقيلة، أو تكوِّن تجمعات من بلورات صغيرة جداً يلتصق بعضها ببعض عشوائياً فتظهر للعين غير مرتبة.[1]
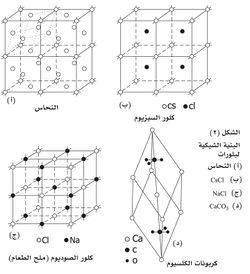
يمكن النظر إلى البنية الشبكية على أنها تكرار دوري لوحدات تسمى خلايا أولية تحمل الصفات التناظرية للبلورة. وإن عدد الوحدات البنائية في بلورة مكعبية (مثل ملح الطعام) ضلعها 1مم يبلغ 1810وحدة، ذلك لأن طول ضلع الوحدة البنائية لهذه البلورة الممثلة في (الشكل -2 جـ) يساوي 5.628 أنگستروم (Aْ=10-10 متر).
وقد تحتل زوايا الخلية الأولية ذرات مفردة كما في الشكل 3، فتسمى شبكة بسيطة أو مجموعة ذرات تسمى عقيدة مثل الجزيئات، لتشكل البنية البلورية التي يمكن النظر إليها أيضاً على أنها تداخل لشبكات بسيطة.
ففي بنية بلورات كلور السيزيوم CsCl (الشكل -2ب) مثلاً توجد شبكتان بسيطتان مكعبتان إحداهما من شوارد (إيونات) السيزيوم والأخرى من شوارد الكلور وتقع إحداهما ضمن الأخرى فتكون ذرا كل مكعب لإحدى الشبكتين في مراكز مكعبات الشبكة الأخرى. كذلك فإن بنية بلورات النحاس (الشكل -2 أ(، تتكون من أربع شبكات مكعبية بسيطة متساوية، تقع الواحدة منها ضمن الأخريات فتتوزع رؤوس مكعباتها في مراكز وجوه مكعبات الشبكات الأخرى. أما بنية ملح الطعام (الشكل -2ج) فإن شوارد الصوديوم والكلور فيها تؤلف شبكتين تقع إحداهما ضمن الأخرى فتشغل شوارد الصوديوم منتصفات أضلاع مكعبات شبكة الكلور والعكس بالعكس.
قلنا أن البلورة تتميز عن المادة المتبلورة في أنه لها أسطحا مستوية خارجية تعرف بالأوجه البلورية. ومنجد أن الأوجه البلورية لها علاقة بالنظام الذري الداخلي. هذه العلاقة نائية من أن هذه الأوجه البلورية تكونت نتيجة لهذا النظام الذري الداخلي ، والملاحظ أنه عندما ترتب الذرات نفسها في أي نظام – أثناء نمو المادة المتبلورة. قد يكون هناك عدد معين من السطوح المحتمل تكونها لتحد البلورة الناتجة وهذا العدد يكون عادة قليلا ، وذلك لأنن المستويات التي تشمل أكبر عدد من الذرات هي التي تحدد أمكنة الأوجه البلورية. أي أن الأوجه البلورية المحتمل تكونها (وفي المادة هي التي تتكون فعلا) ، هي التي تشمل أكبر عدد ممكن من الذرات.
ولما كان البناء الذري الداخلي للمادة المتبلورة ثابت ، وأن الأوجه البلورية – كما أسلفنا – لها ارتباط وثيق بنظام ثابة بالنظام الذري الداخلي ، فإنه ينتج عن ذلك أن الأوجه البلورية الخارجية لابد وأن تكون ذات عرقة ثابتة مع بعضها البعض. هذه العلاقة الثابتة بين الأوجه البلورية توجد في الزوايا التي تكونها الأوجه. وهذه الحقيقة تعرف باسم قانون ثبات الزوايا بين الوجهية Law of constancy of interfacial angles.
وينص هذا القانون على أن زاوية الميل بين وجهين بلورين (زاوية بين وجهية) ثابتة في بلورات المادة الواحدة (عند درجة الحرارة الواحدة). فنجد في الشكل السابق (11) أن الوجه أ ح يعمل زاوية مقدارها 45 مع الوج أب ب في جميع البلورات في هذه المادة ذات النظام الذري المبين (المسافات متساوية بين الذرات في جميع الاتجاهات) ، أما الوجه أ د فإنه يعمل زاوية مقدارها 41 33 درجة مع الوجه أ ب ، ويعمل الوجه أ هـ زاوية مقدارها 34 26 درجة مع الوجه أ ب ، أم الوجه أ و فيعمل زاوية مقدارها 26 18 مع الوجه أ ب.
وهذا القانون أساسي ومهم جدا في علم البلورات ، فبواسطته يمكن التعرف على كثير من العادن ، وذلك إذا قسنا الزوايا بين الوجهين بدقة (بواسطة جهاز يعرف باسم الجونيومتر) إذ أن هذه الزواياة مميزة لكل معدن. ومن أبسط أنواع الجيونيومتر النوع الذي يعرف باسم جونيومتر التماس ، شكل (11) الذي يستعمل في قياس الزوايا بين الوجهية على البلورات الكبيرة ونتائجه دقيقة إلى حد ما.
ويمكن التعرف على طريقة استعماله بملاحظة الشكل (12) ويجب مراعات أن يكون مستوى ذراعي الجيونيومتر متعامدا تماما على حرفي البلورة اللذين يحصران بينهما الزاوية بين الوجهية.
كما يجب ألا يغب عن الذهب أن الزوايا المكملة (الزوايا الداخلة) هي التي تقاس عادة وتدون كقيمة للزوايا بين الوجهية عند دراسة البلور. ففي شكل (13) تسجل الزاوية التي مقدارها 40 درجة وليست الزاوية التي مقدارها 140 درجة.
وأول من لاحظ ثبات الزوايا بين الوجهية هو العالم الدنماركي استينوهام 1669. فعندما قطع مقاطع أفقية في عدد كبير من بلورات الكوارتز شكل (13) ، وجد أن الزاوية بين أي وجهين ، ولكيونا م1 ، م2 مثلا ، مقدارها ثابت بين جميع الأوجه التي تناظر م1 ، م2 في المقاطع الأخرى. هذه الزاوية مقدارها 12- درجة مهما اختلفت البلورات في الشكل الخارجي أو الحجم ، ومن أي مكان جمعت البلورة.
وتختلف بلورة المعدن الواحد في الطبيعة من ناحية مظهرها. فمنها الصغير ومنها الكبير ، ومنها المفلطح ومنها الطويل ، إبريا كان أو منشوريا. ولكننا نجد أنه مهما اختلف المظهر فإن الزوايا بين الوجهية ثابتة. فبلورة مكعبة الشكل شكل (14) قد توجد متساوية الأبعاد أو مفلطحة أو منشورية ، أو ابرية لاشكل ولكن في جميع الحالات تبقى الزاوية بين أي وجهين متناظرين ثابتة ومقدارها في هذه الحالة 90 درجة.
والسبب في ذلك أن المظهر الخارجي للبلورة المكعبة هو الذي تغير ، أما البناء الداخلي وترتيب الذرات فلم يتغير – فالوحدات البنائية التي يتكون منها المكعب شكل (14 ب) ثابتة في جميع المظاهر الخارجية للبلورة. فهي وحدات متساوية الأبعاد ، والذي حدث هو أ،ه أثناء عملية نمو البلورة ، تؤثر الظروف المحيطة على النمو ، فقد تجعل الوحدات البنائية تضاف بنسب متساوية في الأبعاد الثلاثة فينتج المكعب. أو تضاف بسرعة كبيرة في بعدين فقط وبسرعة بطيئة في بعد واحد فتنتج بلورة مفلطحة (نضدية) ، (أقصى اليمين في شكل – 14) ، أو تضاف الوحدات البنائية بسرعة كبيرة نسبيا في بعد واحد فقط فتنتج بلورة منشورية ، أو بسرعة كبيرة جدا في بعد واحد أيضا فتنتج بلورة إبرية (أقصى اليسار في شكل – 14).
ونلاحظ بصفة عامة أن الأوجه البلورية في البلورات الطبيعية (الموجودة في الطبيعة) غير متساوية التكوين. فنجد مثلا أن الأوجه البلورية الثمانية للشكل البلوري المعروف بالسم ثماني الأوجه ، (شكل – 15) لا تكون متساوية في شكل مثلثات متساوية الأضلاع (كما هو الحال في البلورة النموذجية شكل (15- 1) ) ولكن نجد أن هذه الأوجه غير متساوية التكوين ، شكل (15 – ب ، ج) ، ولكن بالرغم من عدم تساوي الأوجه فإن الزوايا بين الوجهية ثابتة ، شكل (15 – د ، هـ ، و).
ويعرف عدم تساوي الأوجه البلورية للشكل البلوري الواحد باسم اختلاف الأوجه البلورية أو النشوء ، وتعرف البلورة في هذه الحالة باسم مختلفة الأوجه البلورية أو مشوهة. والنشوء لا يشير من قيمة الزوايا بن الوجهية بالمرة. وهذا ناتج من أن الأوجه البلورية نفسها ثابتة الميل والاتجاه. لأنها هي الأخرى نتيجة وتعبير للبناء الذري الداخلي المنظم للبلورة شكل (11) ، إذ تكون الأوجه البلورية موازية للمستويات التي تشمل أكبر عدد ممكن من الذرات. وبمان أن الترتيب الذري الداخلي ثابت في جميع بلورات المادة الواحدة ، لذلك كانت الأوجه البلورية المتكونة على جميع هذه البلورات ثابتة الإتجاه أيضا ، وبالتالي تكون الزوايا بينهما ثابتة.
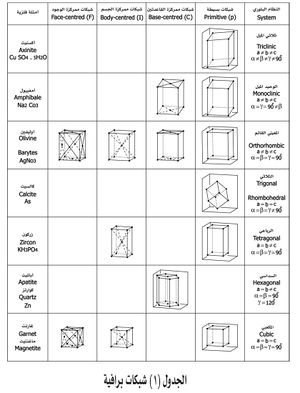
وسط التبلور
يمكن النظر إلى البلورة الكبيرة وكأنها تُبنى على التوالي فتنمو، ويعتمد الوصول بها إلى أحجام كبيرة على الوسط الذي يتم فيه ذلك وتُنمَّى البلورات عبر التحكم بخواص الوسط مثل درجة حرارته وضغطه. قد يكون الوسط غازياً أو بخاراً كما في تشكل بلورات اليود الصغيرة على جدران الأنبوب عند تبريده؛ أو سائلاً مثل تشكل الجليد من الماء أو تشكل الصخور الاندفاعية النارية المتبلورة كالگرانيت من المهل؛ أو صلباً بدءاً من حالة صلبة لا مرتبة إلى حالة بلورية مرتبة، غير أن هذا يستغرق عادة وقتاً طويلاً (ملايين السنين أو مئاتها). استطاع العالم الفرنسي Auguste Bravais اعتماداً على الخواص التناظرية لخلية الوحدة التي تتفق مع التناظر الانسحابي التكراري أن يحصر الإمكانات في أربعة عشر نوعاً أو منظومة. دعيت هذه المنظومات الأربع عشرة شبكات برافيه Bravais lattices (الجدول 1)، ويمكن أن تصنف أيضاً وفق العلاقات بين أطوال أضلاع الخلية الأولية والزوايا بينها، فتظهر في سبعة أنظمة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
عناصر التماثل Element of Symmetry
 مقالة مفصلة: عنصر التماثل
مقالة مفصلة: عنصر التماثل
من الظواهر الملحوظة على كثير من البلورات ظاهرة التوزيع المنظم والمرتب للأوجه البلورية. فإننا نجد أن جميع الأوجه البلورية وكذلك الذرات والأيونات المكونة للمادة مرتبة حسب نظام خاص وتنسيق معين يخضع لقواعد معينة معروفة باسم عناصر التماثل. وجوهر التماثل هو التكرار. فنلاحظ أن وجه البلورة مثلا أو أحد أحرفها يتكرر عدة مرات – أي يوجد في أماكن متماثلة عددا من المرات – طبقا لقانون ثابت. ويعتبر التماثل أساسا في دارسة البلورات.
ويمكن تعريف التماثل في بلورة ما بأنه عبارة عن العمليات التي ينتج عنها أن تأخذ مجموعة معينة من الأوجه البلورية نفس المكان الذي تشغله إحداها. والعمليات التماثلية المعروفة هي:
1- دوران حور محور (محور التماثل الدوراني).
2- انعكاس خلال مستوى (مستوى التماثل).
3- انقلاب حول مركز (مركز التماثل).
4- دوران حول محور مصحوبا بانقلاب (محور التماثل الانقلابي).
ويعرف المحور والمستوى باسم عناصر التماثل.
محور التماثل الدوراني Rotation axis of symmetry
 مقالة مفصلة: تماثل دوراني
مقالة مفصلة: تماثل دوراني
وهو عبارة عن الخط الذي يمر بمركز البلورة والذي تدور أو تلف حوله البلورة وينتج عن هذا أن يتكرر وضع البلورة. أي ظهور وجه أو حرف ما مرتين أو أكثر ومتخذا في كل مرة وضعها مشابها للموضع الاول خلال دورة كاملة (أي 360 درجة) ، أشكل (16 ، 17 ، 18 ، 19).
ويطلق على المحور اسم ثنائي التماثل أو ثلاثي التماثل أو رباعي التماثل أو سداسي التماثل ، حسب عدد المرات التي يظهر فيها الوجه على البلورة في الدورة الكاملة. ففي حالة المحور ثنائي التماثل ، شكل (16) يظهر الوجه كل 180 درجة. ويتكرر وضع البلورة مرتين في 360 درجة. وفي حالة المحور ثلاثي التماثل ، شكل (17) يظهر الوجه كل 120 درجة ، ويتكرر وضع شكل (18) ، فإن الوجه يظهر كل 90 درجة ، ويتكرر وضع البلورة أربع مرات خلال 360 درجة. وفي حالة المحور سداسي التماثل ، شكل (19) ، يظهر الوجه مرة كل 60 درجة ، ويتكرر وضع البلورة ست مرات في الدورة الكاملة. ويرمز للمحاور التماثلية بالرموز الآتية: 2 ، 3 ، 4 ، 6 ، كما تيبن الأشكال بالصور التالي: (يوجد رموز مرسومة).
وقد يتساءل سائل لماذا لا يوجد محور خماسي التماثل أو سباعي التماثل أو أكبر من ذلك؟ والإجابة على ذلك بسيطة إذا علمنا أن الوحدة البنائية ذات التماثل البلوري يجب أن تكون قادرة على التكرار في الفراغ دون أن تترك أي فجوات أو مسافات. فالأشكال الثنائية التماثل وكذلك الثلاثية والرباعية والسداسية تتكرر لمتلأ الفراغ دون أن تترك أي فجوات أو مسافة بينية ، شكل (20- أ ، ب ، ج ، د ، و) ، بينما تترك الأشكال الخماسية والسباعية والثمانية التماثل شكل (20- هـ ، ر ، ع) مسافات وفجوات (مظللة على الرسم) ،وهذا لا يتفق مع الترتيب المنتظم في الفراغ للوحدات البنائية في الأبعاد الثلاثة.
2- مستوى التماثل Plan of symmetry
وهو المستوى الذي يقسم البلورة إلى نصفين متشابهين بحيث إذا وضعنا أحد النصفين أمام مرآة فإن الصورة الناتجة تنطبق تماما على النصف الآخر للبلورة ورمز لمستوى التماثل برمز "م" ( من كلمة مرآة) شكل (21).
3- مركز التماثل Center of symmetry
تحتوي البلورة على لمركز تماثل اذا قابل الخط المار بالمركز من أي نقطة على سطح البلورة نقطة مشابهة لها تماما على الجزء المقابل . أو بمعنى آخر إذا وجد لكل وجه بلوري أو حرف في ناحية من مركز البلورة وجه بلوري مشابه أو حرف في الناحية المقابلة الأخرى من مركز البلورة وعلى مسافة مساوية ، فإن هذه البلورة تحتوي على مركز تماثل شكل (22). ويرمز لمركز التماثل بالرمو "ن" ، (نقطة لاتماثل الداخلية) . والبلورة إما أن تحتوي على مركز تماثل واحد فقط أو لا تحتوي على مركز تماثل بالمرة.
4- محور التماثل الانقلابي Inversion axis symmetry
يجمع هذا العنصر التماثلي بين محور التماثل الدوراني والانقلابي عبر مركز البلورة. ويجب اتمام العمليتين قبل الحصول على موقع التكرار الجديد. فإذا كان يوجد بالبلورة مركز تماثل فإنه يرمز له عادة برمز محور الإنقلاب أحادي التماثل (أ) ، إذ أ، هذا يكافئ دوران نقطة على البلورة دوة كاملة (360 درجة) ثم تكرارها بإنقلابها عبر المركز في الجهة المقابلة لهذه لانقطة على البلورة. وهناك أيضا محاور انقلابية ثنائية وثلاثية ، ورباعية وسداسية التماثل. والآن لنتقهم كيف يعمل محور التماثل الانقلابي ، وليكن مثلا محور انقلابي رباعي التماثل. في حالة محور الدوران الراعي التماثل (شكل-18) ، نلاحظ أن تكرار أربع نقاط (أو أركان) – تبعد الواحدة منها عن الأخرى 90 درجة – يحدث جميعه إما على الجزء الأعلى من البلورة أو على الجزء الأسفل للبلورة . أما في عملية المحور الانقلابي الرباعي التماثل ، فإن النقاط (أو الأركان الأربع سوف تتكرر أيضا كل 90 درجة ، ولكن اثتنتين منها توجد أعلى البلورة ، بينما توجد النقطتان الآخريان أسفل البلورة ، شكل (23). إن عمل مثل هذا المحور الانقلابي التماثل يشمل أربعة دورانات كل 90 درجة ، ويلي ذلك إذا كانت النقطة الأولى في الجزء الأعلى من البلورة ، كانت النقطة الثانية في الجزء الأسفل للبلورة ، والثالثة في الجزء الأعلى والرابعة في الجزء الأسفل. ويرمز للمحاور الانقلابية أحادية ، وثنائية ، وثلاثية ، ورباعية وسداسية التماثل بالرموز التالية على التوالي: 1 ، 2 ، 3 ، 4 ، 6
واذا فحصنا الأشكال السابقة ، (16) إلى (19) ، شكل (21) بشئ من الدقة والتفصيل ، فإننا نلاحظ أن كلا من هذه البلورات المرسومة تحتوي أكثر من عنصر التماثل المبين في الشكل. فالبلورة المبينة في شكل (16) مثلا تحتوي على محورين آخرين ثنائي التماثل ، كما تحتوي على ثلاثة مستويات تماثلية وتحتوي أيضا على مركز تماثل ، بينما البلورة المبينة في شكل (21) تحتوي على محور ثنائي التماثل عمودي على مستوى التماثل الموضح ، وكذلك تحتوي على مركز تماثل. أما البلورة المبينة في شكل (22) ، فإنها لا تحتوي سوى مركز التماثل المبين بها. وأكبر عدد من عناصر التماثل يمكن أن يوجد في بلورة واحدة هو 23 ، كما سنرى بعد ، أما أقل عدد ، فهناك بلورات لا تحتوي على عناصر تماثل بالمرة.
قانون التماثل Symmetry formula
 مقالة مفصلة: التماثل في الرياضيات
مقالة مفصلة: التماثل في الرياضيات
يمكن كتابة عناصر التماثل في البلورة في هيئة قانون يعرف باسم قانون التماثل الكامل Complete Symmetry formula ، وذلك باستعمال الرموز التماثلية وهي: 2 ، 3 ، 4 ، 6 ، للمحاول الدورانية الثنائية والثلاثية والرباعية والسداسية التماثل على التوالي و 1 ، 2 ، 3 ، 4 ، 6 للمحاور الانقلابية الأحادية والثنائية والثلاثية والرباعية والسداسية التماثل على التوالي ن م لمستوى التماثل ، ن لمركز التماثل. فاذا وجد محور دوران تماثلي عموديا على مستوى تماثل فإن القانون يكتب هكذا 2/م أو 3/م ، الخ ... حسب درجة المحور التماثل ، ويقرأ اثنين على ميم ، وثلاثة على ميم ، الخ .. أما إذا كان المحور التماثلي يمر في المستوى التماثلي وليس عموديا عليه ، فإن القانون يكتب 2م أو 3 م الخ .. حسب درجة المحور التماثلي. أما في حالة وجود مستويان تماثليان أحدهما عمودي على المحور التماثلي والآخر يمر بالمحور فإن القانون يكتب 2/م م أو 3/م م ، الخ. وفي حالة وجود أكثر من محور تماثل واحد أو مستوى تماثل واحد فإن عدد المحاور أو المستويات يكتب في لاركب الأعلى الشمالي لرمز المحور أو المستوى هكذا 32 ، م3 ، 4/م 3 أي ثلاثة محاور ثنائية التماثل ، ثلاث مستويات تماثلية ، ثلاثة محاور رباعية التماثل عمودية على ثلاث مستويات تماثلية ، على التوالي ( لاحظ أن القانون الأخير لا يعني ثلاثة محاول رباعية التماثل عمودية على مستوى تماثل واحد ، إذ أن 4/م تدل على مجموعة غير مجزأة).
الفصائل والمحاور البلورية
الفصائل البلورية Crystallographic systems
 مقالة مفصلة: تركيب بلوري
مقالة مفصلة: تركيب بلوري
تتبع البلورات سبعة أقسام تعرف باسم الفصائل البلورية السبعة ، يمكن التعرف عليها على أساس المحاول التماثلية الموجودة كما يلي:
1 – فصيلة المكعب (أو متساوي الأطوال) وتشمل جميع البلورات التي تحتوي على أربعة محاور ثلاثية التماثل.
2- فصيلة السدساسي ، وتشمل جميع البلورات التي تحتوي على محور واحد سداسي التماثل فقط.
3- فصيلة الرباعي ، وتشمل جميع البلورات التي تحتوي على محور رباعي التماثل فقط.
4- فصيلة الثلاثي ، وتشمل جميع البلورات التي تحتوي على محور واحد ثلاثي التماثل فقط.
5 – فصيلة المعيني القائم ، وتشمل جميع البلورات التي تحتوي على ثلاثة محاور ثنائية التماثل.
6- فصيلة الميل الواحد ، وتشمل جميع البلورات التي تحتوي على محور واحد ثنائي التماثل فقط.
7- فصيلة الميول الثلاثة ، وبلوراتها لا تحتوي على آية محاور تماثلية.
وتضم كل فصيلة من هذه الفصائل السبعة عددا من المجموعات التماثلية ، أو ما يعرف باسم النظم البلورية (اثنين في فصيلة الميول الثلاثة ، وثلاثة في كل من فصيلتي الميل الواحد والمعيني القائم ، خمسة في كل من فصيلتي الثلاثي والمكعب ، سبعة في كل من فصيلتي الرباعي والسداسي) وتحتوي على المميزات التماثلية للفصيلة التي تتبعها ، فمثلا ، قد تحتوي بلورة تابعة لفصيلة الثلاثي على محور دوران ثلاثي التماثل فقط ، أو على محور انقلابي ثلاثي التماثل ، أو على مجموعة من محور واحد ثلاثي التماثل ، وثلاثة محاور ثنائية التماثل ، أو ثلاثة مستويات تماثل ، أو كليهما. معنى ذلك أن فصيلة الثلاثي تضم خمسة نظم بلورية. وعلى هذا الأساس وجد أن الفصائل البلورية لاسبعة تضم 32 نظاما بلوريا ، وفي كل فصيلة يوجد نظام واحد يحتوي على أعلى تماثل بين النظم التابعة لهذه الفصيلة. ويعرف هذا النظام باسم النظام الكامل التماثل.
وسوف نكتفي في مناقشاتنا الحالية بدراسة النظام الكامل التماثل في كل فصيلة بالتفصيل ، أما النظم الأقل تماثلاا في كل فصيلة فسوف نشير إليها في أول الحديث عن الفصيلة. ويجدر بنا أن نشير في هذا المقام إلى أن بعض المؤلفين في بعض الدول يعتبرون فصيلة الثلاثي قسما تابعا لفصيلة السداسي ، وهذا يعني ستة فصائل بلورية فقط ، ولكن العدد الكلي لمجموعات التماثل المختلفة (النظم البلورية) موزعة على هذه الفصائل الستة بعينة نفس العدد (32) الذي يضمه التصنيف إلى سبعة فصائل.
المحاور البلورية Crystallographic axes
 مقالة مفصلة: محور بلوري
مقالة مفصلة: محور بلوري
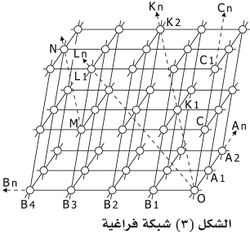
المحاور البلورية هي عبارة عن ثلاثة خطوط تصورية أو خيالية ، شكل (24) ، (أربعة في فصيلتي السداسي والثلاثي) والتي يمكن رسمها داخل البلورة بحيث تتقاطع في مركز البلورة (مركز النقل) ، وتعمل كخطوط ترجع إليها كلما أردنا وصف مواضع الأوجه البلورية (كل وجه لابد أن يقطع واحدا أو أكثر من هذه المحاول البلورية على مسافة معينة من المراكز).
واتجاهات المحاور البلورية محددة على البلورة بواسطة العناصر التماثلية الموجودة ، إذ غالبا ما يكون محور التماثل محورا بلوريا وخصوصا بالنسبة للمحور البلوري الرأسية (ج) الذي يمثل في غالبية الأحوال المحور الأكثر تماثل. وينتج عن تقاطع المحاور البلورية ما يسمى بالمتقاطع البمحوري Axial cross ، وبرمز إلى وحدات المحاول البلورية إذا كانت متساوية بالرموز 111. أما إذا كانت الوحدات التماثلية مختلفة الأطوال فإنه يرمز إليها بالرموز أ ، ب ، ج ، حيث أ هو المحور الممتد من الأمام إلى الخلف (الاجاه س) ، ب المحور المتد من اليمين إلى اليسار (الاتجاه ص) ، ج هو المحور الممتد رأسيا (الاجاه ع). ونفرق أطوال هذه الحاول باوسطة استعمال الاشارات الموجبة (+) ، والسالبة (-) ، شكل (24).
وينتج عن تقاطع هذه المحاول الثلاثة زوايا تعرف باسم الزوايا المحورية ، وهي زاوية ألفا (α) بين بن ، ج ، وزاوية بيتا (β) بين أ ، ج ، وزاوية جاما (δ) بين أن ، ب.
وعلى أساس أطوال وحدات المحاور البلورية، والزوايا بين هذه المحاول ، يمكننا لتمييز بين الفصائل البلورية السبعة كما هو مبين في الجدول:
اسم الفصيلة الزوايا بين المحاور طول الوحدة في الاتجاهات
α β δ س ص (ط) ع
الطول الواحد المكعب 90 90 90 أ أ أ
السداسي 90 90 120 أ أ أ ج
الطولين الرباعي 90 90 90 أ أ ج
الثلاثي α = β= δ ╪ 90 أ أ أ ج
الأطوال الثلاثة المعيني القائم 90 90 90 أ ب ب ج
الميل الواحد 90 >90 90 أ ب ب ج
الميول الثلاثية > 90 >90 90 أ ب ب ج
جدول (2) الفصائل البلورية وخواصها
وتبين الأشكال (25) إلى (31) ، المحاور البلورية المميزة لكل فصيلة بلورية ، ومثالات من بلورات المعادن التي تنتمي إليها هذه الفصيلة. والوحدة البنائية لهذه الفصيلة.
ويجدر بنا الإشارة في هذا المكان إلى أن المحور البلوري ج هو دائما محور سداسي التماثل في فصيلة لاسداسي ، ورباعي التماثل في فصيلة الرباعي، وثلاثي التماثل في فصيلة الثلاثي . وتختلف فصيلة الثلاثي عن السداسي ، بجانب الاختلافات السابقة، في أن فصيلة الثلاثي لا تحتوي بلوراتها على مستوى تمثالي أفقي.
تعليمات بشأن اختيار المحاور البلورية : (في النظم الكاملة التماثل)
فصيلة المكعب: المحاور الرباعية التماثل هي المحاور البلورية.
فصيلة السداسي: المحور السداسي التماثل هو المحور ج ، وأطول ثلاثة محاور ثنائية التماثل هي المحاور 1 أ 1 ، أ2 ، أ3.
فصيلة الرباعي: المحور الرباعي التماثل هو المحور ج ، وأطول محورين ثنائي التماثل هما ، المحورات أ1 ، أ2.
فصيلة الثلاثي: المحور الثلاثي التماثل هو المحور ج ، وأطول ثلاثة محاور ثنائية التماثل هي المحاور أ1 ، أ2 ، أ3.
فصيلة المعيني القائم: الثلاثة محاور الثنائية التماثل هي المحاور البلورية ، وفي العادة يختار ج أطول من ب ، وب أطول من أ.
فصيلة الميل الواحد : المحور الثنائي التماثل هو المحور ب ، يختار بعد ذلك المحور ج موازيا لحروف أربعة أوجه متشابهة تماما والتي تعتبر مكونة للشكل المنوشري ، وبعد ذلك يختار المحور أ موازيا للسطحين الذين يقطعان أوجه المنشور بزاوية تقرب من القائمة.
فصيلة الميول الثلاثة: ابحث عن ثلاثة أزواج من السطوح المتوازية التي تتقاطع مع بعضها بزوايا تقرب من القائمة والتي تحد الفراغ كعلبة كبريت مشوهة ، وتختار المحاور الببلورية موازية لهذه الأسطح (كل محور موازي لمجموعتين من هذه المجموعات الثلاث) (كل مجموعة تتكون من سطحين). غالبا يكون ج>ب>أ. تصنف البلورات تبعاً لثوابتها الهندسية وعناصر التناظر فيها، في سبعة أنظمة بلورية (انظر الجدول ـ1).
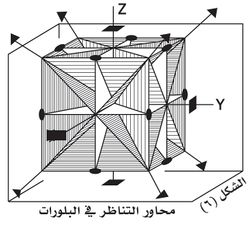
فالنظام ثلاثي الميل Triclinic System الذي سُمِّي بذلك لوجود ثلاث زوايا مائلة بين أضلاع متوازي وجوه الشبكات الأولية في البنية الفراغية لبلوراتها. ويتضمن هذا النظام محور تناظر L1. يتميز النظام وحيد الميل بوجود محور تناظر من الدرجة الثانية L2. أما النظام المعيني القائم orthorhombic system الذي سمِّي بذلك لاتخاذ بلورات هذا النظام أشكالاً تكون فيها المقاطع العمودية على المحاور التناظرية الثنائية معينية الشكل، ولكون الزوايا الكائنة فيما بين أضلاع متوازيات الوجوه في بنيتها الفراغية قائمة. يتميز بوجود ثلاثة محاور تناظر من الدرجة الثانية 3L2 وهكذا بالنسبة لبقية الأنظمة البلورية حتى النظام المكعبي الذي يتميز بأكبر عدد من العناصر التناظرية المبينة في الشكل 6 مع رموزها.
وتصنف الأنظمة البلورية أيضاً في ثلاث زمر بلورية (أو تناظرية)، تتمتع بلورات كل زمرة منها بصفات هندسية (تناظرية) مشتركة ترتبط بها صفات فيزيائية عامة محددة وضوئية خاصة.
الزمرة الدنيا lower category: تضم هذه الزمرة الأنظمة البلورية: الثلاثي الميل ووحيد الميل والمعيني القائم، وتتميز بلوراتها بعدم وجود محاور تناظر أعلى من الدرجة الثانية، وتتصف ضوئياً بدالة قرينة انكسار ضوئية ثنائية المحور الضوئي biaxial indicatrix أي تتغير قرينة انكسارها بتغير اتجاه انتشار الضوء وبوجود محاور تقابل نهايات في قرائن الانكسار الرئيسية.
الزمرة الوسطى: middle categery تضم الأنظمة البلورية: الثلاثي والرباعي والسداسي، وتتصف ضوئياً بدالة ضوئية وحيدة المحور الضوئي uniaxial indicatrix، ينطبق محورها الضوئي دوماً على المحور التناظري الرئيسي في بلوراتها.
الزمر العليا: higher category تضم هذه الزمرة النظام البلوري المكعبي فقط، وتتصف ضوئياً بدالة ضوئية كروية، أي إن بلوراتها تتصف بأنها متماثلة المناحي isotropic.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التلاصقات البلورية
لدى دراسة البلورات الفلزية المتوافرة في الطبيعة، تبين أنها نادراً ما تكون منفردة، وهي تشاهد عادة على شكل تجمعات متلاصقة فيما بينها. وتحدث عمليات التلاصق macle بالمصادفة عند تماس البلورات الناشئة من التركيب والبنية نفسيهما في أوساط النمو وفق اتجاهات عشوائية أو عند النمو موجَّهة بحسب نظم وقوانين محدَّدة، ويحدث التلاصق أيضاً عند انتقال البلورات من نظام بلوري إلى آخر نتيجة عدم الاستقرار؛ وقد يتم التلاصق بين بلورات من فلزين مختلفين أو أكثر. وتبعاً لذلك يكون التلاصق غير نظامي أو نظامياً أو متعدد الأشكال أو تقيُّلياً epitaxic.
التلاصقات غير النظامية
وتحدث عادة في الأوساط السريعة التبلور أو غير المستقرة، فتحدث تجمعات تتوضع ضمنها البلورات عشوائياً وتؤلف ما يدعى بالمجموعات البلورية؛ حيث تكون الالتصاقات فيما بين بلوراتها ضعيفة، وقد تكون مؤلفة من فلز أو عدة فلزات.
التلاصقات النظامية
وتحدث عادة بين بلورات من التركيب والبنية نفسيهما في أوساط مستقرة وهادئة بعض الشيء. وتلتصق البلورات في هذه الحالة وفق توجهات محددة بعضها بالنسبة إلى بعض، ويكون تلاصقها إلى جوار بعضها إما على التوازي المتماثل (أو ما يقارب التوازي) أو وفق توجهات متباينة ومحددة بقوانين ناظمة. وتبعاً لذلك يفرَّق في التلاصقات النظامية ما بين تلاصقات متوازية وتلاصقات متوأمة.
التلاصقات المتعددة الأشكال (البوليمورفية)
تحدث هذه التلاصقات حين تنتقل بلورات فلزٍ ما جزئياً من بنية بلورية إلى بنية أخرى مغايرة مع الاحتفاظ بالتركيب والشكل الخارجي نفسيهما، نتيجة عدم استقرار البنية الأولى في شروط جديدة من الضغط والحرارة، مثال ذلك انتقال بتا ـ كوارتز b-Quartz السداسي العالي درجة الحرارة جزئياً إلى ألفا ـ كوارتز a-Quartz الثلاثي المنخفض درجة الحرارة، ولا يشكل الأخير بلورات منفردة أو تجمعات بلورية غير موجهة بل يشكل توائم موجهة ذات سطوح التصاق متعرجة أو متدرجة أو معقدة، وفي هذه الحالة لا يتغير الشكل الخارجي للكوارتز السداسي الأولي ولا تركيبه.
التلاصقات التَقَيُلية (الإبيتاكسية epitaxy)
لا تقتصر الالتصاقات النظامية على البلورات من التركيب والبنية نفسيهما أي من الفلز نفسه، بل هناك أمثلة كثيرة تحدث فيها توأمية نظامية فيما بين بلورات مختلفة ومتباينة من حيث التركيب الكيمياوي والبنية الداخلية (أي من فلزات مختلفة). ويتحقق الالتصاق فيها حسب سطوح تُقابل في البلورات الملتصقة شبكات مستوية متشابهة في المسافات العقيدية والزوايا بين الصفوف الشبكية. وتعطي مثل هذه الالتصاقات توائم سميت بالتوائم التَقَيُلِيّة (أو الإيبتاكسية). ومن الأمثلة المشهورة في هذا الصدد: التوأمية الحاصلة بين بلورات الموسكوفيت mouscuvite الوحيدة الميل وبلورات يود البوتاسيوم المكعبي.
التقنية
علم البلورات في المواد الهندسية
يركز علم هندسة البلورات على طرائق دراسة البلورات هندسياً من حيث شكلها الخارجي. وذلك عن طريق قياس الزوايا goniometry بين الوجوه وتحديد تناظراتها فراغياً؛ أو من حيث بنية البلورات الداخلية بطريقة ڤيلهلم رونتگنWilhelm Röntgen، وفيها يُدرس تحليل البنية الشبكية الفراغية الداخلية للبلورات باستخدام الأشعة السينية x-ray.
علم فيزياء البلورات
يهتم بدراسة الصفات الفيزيائية للبلورات وعلاقة هذه الصفات بخواصها الهندسية التي ترتبط بدورها بالخصائص البنيوية الهندسية لبنيتها الداخلية.
وتغلب في فرع فيزياء البلورات دراسة الصفات الميكانيكية والكهربائية والمغنطيسية وخاصة دراسة ضوئيات البلورات المستخدمة على نطاق واسع في دراسة الفلزات والصخور وتحليلها.
علم كيمياء البلورات
يتضمن هذا الفرع الدراسات النظرية والعملية في منشأ البلورات ونموها، ويب حث في تأثير البنية الداخلية والعوامل الخارجية في سرعة نمو البلورات، ويدرس التركيب الكيمياوي للبلورات. ويؤلف هذا الفرع واحدة من أهم دعائم الجيوكيمياء geochemistry وذلك بكشفه عن منشأ الفلزات ومنها فلزات المكامن المعدنية وغيرها.
علم الأحياء
 مقالة مفصلة: علم بلورات الآشعة السينية
مقالة مفصلة: علم بلورات الآشعة السينية
علماء
- وليام هنري براگ
- وليام لورنس براگ
- أوگست براڤيه
- پيير كوري
- فرانسيس كريك
- بوريس ديلون
- Paul Peter Ewald
- Rosalind Franklin
- René Just Haüy
- كارل هرمان
- Robert Huber
- Ernest-François Mallard
- Georges Friedel
- Charles-Victor Mauguin
- William Hallowes Miller
- دوروثي كروفوت هودجكين
- Max Perutz
- Hugo Rietveld
- Jean-Baptiste L. Romé de l'Isle
- Constance Tipper
- Don Craig Wiley
- أدا يونث
انظر أيضا
|
|
معرض الصور
انظر أيضاً
- Atomic packing factor
- Crystal
- Crystal engineering
- Crystal optics
- Crystal system
- Crystallite
- Crystallization processes
- Crystallographic group
- حيود
- Dynamical theory of diffraction
- Electron crystallography
- Molecular modelling
- Powder diffraction
- Symmetry group
- علم بلورات الآشعة السينية
- تركيب بلورى
قراءات إضافية
- Burns, G. (1990). Space Groups for Scientists and Engineers (2nd ed.). Boston: Academic Press, Inc. ISBN 0-12-145761-3.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Clegg, W (1998). Crystal Structure Determination (Oxford Chemistry Primer). Oxford: Oxford University Press. ISBN 0-19-855-901-1.
- Drenth, J (1999). Principles of Protein X-Ray Crystallography. New York: Springer-Verlag. ISBN 0-387-98587-5.
- Giacovazzo, C (1992). Fundamentals of Crystallography. Oxford: Oxford University Press. ISBN 0-19-855578-4.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Glusker, JP (1994). Crystal Structure Analysis for Chemists and Biologists. New York: VCH Publishers. ISBN 0-471-18543-4.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - O'Keeffe, M. (1996). Crystal Structures; I. Patterns and Symmetry. Washington, DC: Mineralogical Society of America, Monograph Series. ISBN 0-939950-40-5.
{{cite book}}: Italic or bold markup not allowed in:|publisher=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help)
Applied Computational Powder Diffraction Data Analysis
- Young, R.A., ed. (1993). The Rietveld Method. Oxford: Oxford University Press & International Union of Crystallography. ISBN 0-19-855577-6.
المصادر
- ^ غالب سيدا. "البلورات (علم ـ)". الموسوعة العربية.
محمد عز الدين حلمي (2002). علم المعادن. القاهرة، مصر: مكتبة الأنجلو المصرية. {{cite book}}: Cite has empty unknown parameter: |coauthors= (help)
وصلات خارجية
- Introduction to Crystallography and Mineral Crystal Systems
- Crystallographic Teaching Pamphlets
- Crystal Lattice Structures
- Freely Available Crystallographic Software for Academia
- NetSci Software Listing for Crystallography
- SINCRIS Information Server for Crystallography
- ORTEP a professional grade viewer for use on a PC which is based on the FORTRAN code which came from Oak Ridge
- Vega Science Trust Interviews on Crystallography Freeview video interviews with Max Pertuz, Rober Huber and Aaron Klug.
- Commission on Crystallographic Teaching, Pamphlets
- Crystallography site of Steffen Weber with lots of Java Applets
- IUCr Online Dictionary of Crystallography
- American Crystallographic Association
- Laue Measurement of Single-Crystal Turbine Blades
- Ames Laboratory, US DOE Crystallography Research Resources