حمض البنزويك
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك المفضل
Benzoic acid[1] | |||
| اسم أيوپاك النظامي
Benzenecarboxylic acid | |||
أسماء أخرى
| |||
| Identifiers | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| مرجع بايلستاين | 636131 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.562 | ||
| رقم EC |
| ||
| E number | E210 (preservatives) | ||
| مرجع Gmelin | 2946 | ||
| KEGG | |||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| InChI | InChI={{{value}}} | ||
| SMILES | |||
| الخصائص | |||
| الصيغة الجزيئية | C7H6O2 | ||
| كتلة مولية | 122.11 g mol-1 | ||
| المظهر | Colorless crystalline solid | ||
| الرائحة | Faint, pleasant odor | ||
| الكثافة | 1.2659 g/cm3 (15 °C) 1.0749 g/cm3 (130 °C)[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 1.7 g/L (0 °C) 2.7 g/L (18 °C) 3.44 g/L (25 °C) 5.51 g/L (40 °C) 21.45 g/L (75 °C) 56.31 g/L (100 °C)[2][3] | ||
| قابلية الذوبان | soluble in acetone, benzene, CCl4, CHCl3, alcohol, ethyl ether, hexane, phenyls, liquid ammonia, acetates | ||
| قابلية الذوبان في methanol | 30 g/100 g (-18 °C) 32.1 g/100 g (-13 °C) 71.5 g/100 g (23 °C)[2] | ||
| قابلية الذوبان في ethanol | 25.4 g/100 g (-18 °C) 47.1 g/100 g (15 °C) 52.4 g/100 g (19.2 °C) 55.9 g/100 g (23 °C)[2] | ||
| قابلية الذوبان في acetone | 54.2 g/100 g (20 °C)[2] | ||
| قابلية الذوبان في olive oil | 4.22 g/100 g (25 °C)[2] | ||
| قابلية الذوبان في 1,4-Dioxane | 55.3 g/100 g (25 °C)[2] | ||
| log P | 1.87 | ||
| ضغط البخار | 0.16 Pa (25 °C) 0.19 kPa (100 °C) 22.6 kPa (200 °C)[4] | ||
| الحموضة (pKa) | |||
| القابلية المغناطيسية | -70.28·10−6 cm3/mol | ||
| معامل الانكسار (nD) | 1.5397 (20 °C) 1.504 (132 °C)[2] | ||
| اللزوجة | 1.26 mPa (130 °C) | ||
| البنية | |||
| البنية البلورية | Monoclinic | ||
| الشكل الجزيئي | planar | ||
| Dipole moment | 1.72 D in dioxane | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
-385.2 kJ/mol[2] | ||
| الانتالبية المعيارية للاحتراق ΔcH |
-3228 kJ/mol[4] | ||
| Standard molar entropy S |
167.6 J/mol·K[2] | ||
| سعة الحرارة النوعية، C | 146.7 J/mol·K[4] | ||
| المخاطر | |||
| خطر رئيسي | Irritant | ||
| صفحة بيانات السلامة | JT Baker | ||
| ن.م.ع. مخطط تصويري |   [7] [7]
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H318, H335[7] | |||
| P261, P280, P305+P351+P338[7] | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 121.5 °C (250.7 °F; 394.6 K)[8] | ||
| 571 °C (1,060 °F; 844 K)[8] | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
1700 mg/kg (rat, oral) | ||
| مركبات ذا علاقة | |||
carboxylic acids ذات العلاقة
|
Hydroxybenzoic acids Aminobenzoic acids, Nitrobenzoic acids, Phenylacetic acid | ||
مركـّبات ذات علاقة
|
Benzaldehyde, Benzyl alcohol, Benzoyl chloride, Benzylamine, Benzamide | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
حمض البنزويك أو حمض الصمغ الجاوي مركب عضوي له الصيغة الكيميائية C7H6O2 أو C6H5COOH ، وهو أبسط الأحماض الكربوكسيلية العطرية. The name is derived from gum benzoin, which was for a long time its only source. Benzoic acid occurs naturally in many plants[9] and serves as an intermediate in the biosynthesis of many secondary metabolites. Salts of benzoic acid are used as food preservatives. Benzoic acid is an important precursor for the industrial synthesis of many other organic substances. The salts and esters of benzoic acid are known as benzoates /ˈbɛnzoʊ.eɪt/.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
اكتـُشف حمض البنزويك في القرن السادس عشر. التقطير الجاف للبنزوين الراتنجي وصفه لأول مرة نوستراداموس (1556)، ثم تبعه ألكسيوس پدمونتانوس (1560) وبليز ڤيجنير (1596).[10]
يوستوس فون لايبگ وفريدريش ڤولر حددا بنية حمض البنزويك في 1832.[11] كما بحثا في كيفية ارتباط حمض الهيپوريك بحمض البنزويك.
وفي 1875، اكتشف سالكوسكي القدرات المضادة للفطريات لحمض البنزويك، والتي اُستـُخدِمت لزمن طويل في حفظ فواكه التوت البري المحتوية على البنزوات.[12]
لقد عرف التأثير الحافظ لحمض البنزويك لأول مرة بواسطة العالم H. FLECK في عام 1875 الذي حاول إيجاد بديل لحمض الساليسيليك , وهذا العالم هو الذي ربط بين فاعلية كل من الحامضين وفاعلية الفينولات ولم يكن إنتاج حمض البنزويك بكميات كبيرة متاحاً بشكل صناعي , لذا فإن استخدامه في حفظ الأغذية بدأ فقط مع بداية القرن الماضي حيث أصبح من أكثر المواد الحافظة استخداماً على مستوى العالم بأسره .
يستخدم حمض البنزويك في صورته الطبيعية ومن المعروف أن هذا الحمض يوجد بشكل طبيعي في بعض الأغذية كالتوت البري , كما يمكن استخدامه على صورة أملاح الصوديوم أو البوتاسيوم أو الكالسيوم , أما البنزوات على هيئة بارا هيدروكسي بنزوات الصوديوم فهي أكثر فعالية من أملاحه سابقة الذكر , كذلك تعد أسترات البارا هيدروكسي بنزوات ( ميتيل – بروبيل – بيتيل ) أكثر تأثيراً من الباراهيدروكسي بنزوات .
التعريف
حمض البنزويك حمض عضوي متبلور. لا يذوب في الماء،ويذوب في الكحول والكلوروفورم والأثير والدهون والزيوت. يوجد في حمض السنامكي، في بنزوين المطاط.ويركب من هيدروكربون قطران الفحم الحجري ؛ التولين.
الاستخدامات
يستخدم كحافظ ومطهر في علاج الدودة السعفة وفي علاج التهاب القصبات المقشع.[13].
ويستخدم حمض البنزويك وأملاحه بشكل واسع في حفظ الأغذية الحامضية وذلك كون البنزوات تمارس فعاليتها ضد الأحياء الدقيقة بشكل أكبر على درجة حموضة مرتفعة في حين تنخفض هذه الفعالية بانخفاض الحموضة واقترابها من الاعتدال. وفي المقابل يمكن استخدام حمض البنزويك في حفظ المرجرين على الرغم من عدم كونه المادة الحافظة المثلى لأن درجة الحموضة للمارجرين تقع في آخر المجال الذي يعطي فيه حمض البنزويك أعلى فاعليته، حيث يتراوح التركيز المستخدم بين 0.08-0.15% ويوضع حمض البنزويك في الوسط الدهني أو بنزوات الصوديوم في الوسط المائي.
كما يستخدم حمض البنزويك في حفظ المايونيز وذلك على هيئة خليط من بنزوات الصوديوم وسوربات البوتاسيوم الأمر الذي يؤدي إلى إعطاء قدرة أعلى ضد البكتريا المنتجة للحموضة , ويستخدم حمض البنزوات بتراكيز 0.8-1.2% في حفظ صفار البيض السائل المملح وغير المملح , كما يستعمل حمض البنزوات في حفظ بيوض الأسماك وفي حفظ عصير الفاكهة والشرابات ورب البندورة والمخللات وذلك بنسبة أقل من 0.1% .
أما بالنسبة لإسترات حمض باراهيدروكسي بنزويك وبخاصة إسترات الميثيل والبروبيل ومشتقاتها الصودية فإن لها فائدة مضاعفة نظراً لانحلاليتها الجيدة وحساسيتها الضعيفة لدرجة الحموضة مما يسمح باستعمالها في أوساط قريبة من الاعتدال، حيث تمتاز هذه المركبات بفعاليتها الكبيرة ضد الخمائر والفطريات وبدرجة أقل ضد البكتريا وبخاصة سالبة الجرام. لكن في المقابل تمتاز هذه المركبات بفاعليتها الكبيرة تجاه البكتريا موجبة الجرام مقارنة بحمض البنزويك وحمض السوربيك وذلك نتيجة لوجود مجموعة الهيدروكسيل الفينولية. [14].
التحضير
صناعياً يحضر حمض البنزويك من أكسدة التولوين بوجود حفاز من الكوبالت أو من نفثينات المنگنيز.
الكيمياء
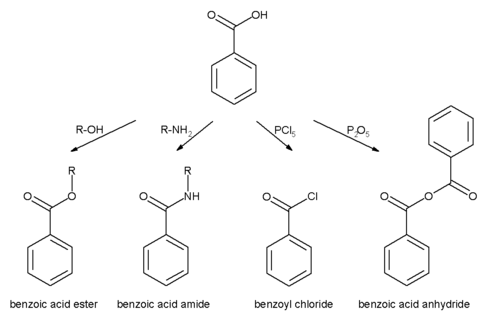
تفاعلات حمض البنزويك يمكن أن تحدث إما عند حلقة عطرية أو عند مجموعة كربوكسيل:
يتراوح الوزن الجزيئي لحمض البنزوات 121.11 وهو عبارة عن بلورات إبرية أو ورقية بيضاء اللون لامعة , تنصهر على درجة حرارة 122مْ , وتتراوح درجة انحلاليته في الماء 0.34جرام ⁄ 100جرام ماء , بينما ينحل 1-2 جرام من حمض البنزويك في 100جرام زيت , وفي المقابل يتراوح الوزن الجزيئي لبنزوات الصوديوم 144.11 وتتراوح انحلاليتها 63جرام ⁄ 100جرام ماء .
تعتمد فاعلية حمض البنزويك ضد الأحياء الدقيقة على عدة تفاعلات مع التركيب الأنزيمي للخلية الميكروبية , حيث يعمل حمض البنزويك على تثبيط الأنزيمات لتي تتحكم في تمثيل حمض الخليك وفي إضافة حمض الفسفور عن طريق الأكسدة , كما يقوم حمض البنزويك بالتدخل في دورة حمض الستريك وذلك في أماكن متعددة وخصوصاً في أنزيمات الهيدروجينيز مثل α-Ketoglutaric and succinic acid dehydrogenases , كما أن حمض البنزويك يمنع تكاثر الخلية الخضرية قبل عملية التبوغ.
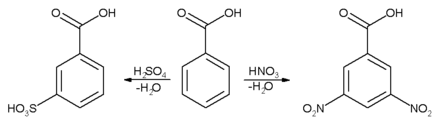
حلقة عطرية
المصادر
|
قراءات اضافية
- Cosmetic Ingredient Review Expert Panel Bindu Nair (2001). "Final Report on the Safety Assessment of Benzyl Alcohol, Benzoic Acid, and Sodium Benzoate". Int J Tox. 20 (Suppl. 3): 23–50. doi:10.1080/10915810152630729.