شبه قلوي
أشباه القلويات أو القلويدات مركبات عضوية نتروجينية ، تتواجد بشكل كبير كمنتجات طبيعية في النباتات ذات الاستعمال الطبي ، حيث تمتلك تأثيرا فيزيولوجيا ودوائيا كبيرا على الإنسان و الحيوانات. ويحتوي شبه القلوي على الكربون والهيدروجين والنيتروجين والأكسجين. وللكميات البسيطة من المركبات شبه القلوية عادة تأثير فعال في الإنسان والحيوان، وتستعمل أدوية أو سمومًا. وبعض المركبات شبه القلوية يركب صناعيا في المعامل الكيميائية، ومنها ما يؤخذ من النباتات.
وتضم المواد شبه القلوية ذات الأهمية الطبية: الكوديين والمورفين ويستخرجان من نبات الخشخاش، والكينين والكيندين ويستخرجان من الكينا. وهناك الكافيين من القهوة والشاي والكوكايين من الكوكا والأفيدرين عقَّار لمعالجة الزكام والربو من الإفيدرا وهو جنس من النباتات، والريزربين من نبات الراولفية سربنتنيا والتوبوكورارين من مستخلص الكورار السام.
وتستخدم المادة شبه القلوية السامة المستخرجة من مستخلص نبات الكورار لدى بعض رجال القبائل البدائيين لتسميم السهام. ويحتوي نبات الشوكران (نبات سام)، الذي استخدم لإعدام الفيلسوف اليوناني سقراط، على كميات قاتلة من الكونيين والمواد شبه القلوية الأخرى. وكذلك فإن الكونتين المستخرج من نبات الأقونيطن شديد السمية. والنيكوتين المستخرج من التبغ مادة سامة للإنسان وتستعمل لقتل الحشرات.
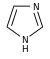
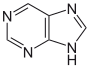
تتكون القلوانيات من حلقات كيميائية غير متجانسة؛ لذلك يصنف القلواني (القلويد) تبعاً لطبيعة الحلقة المكونة له إلى مجموعات مثل البيرولات والبيروليدينات والبيريدينات والببيريدينات والإندولات، والكينولئينات والإيزوكينوليئنات والإيميدازولات والبيريميدينات (الشكل 1). كما توجد أيضاً قلوانيات أخرى تنتج من تكاثف أكثر من نواة أو مجموعة من المجموعات سابقة الذكر، إضافة إلى وجود مجموعة صغيرة من المواد غير معروفة التركيب والتي تشبه القلوانيات. يضاف إلى ذلك القلوانيات الحيوانية المنشأ، والتي تنتج من تخرب لحوم الحيوانات نتيجة تفاعلات خمائرية جرثومية بعضها قابلة للتبلور، وهي سامة جداً، تتصف بخواص القلوانيات النباتية، أَطلَق عليها سلمي Selmi اسم الشلوين أو تومائين ptomaine، وهي مواد مهمة من الناحية الحيوية والدوائية والتحليلية والسمية، وهي المسؤولة عن التسممات الغذائية المنشأ التي تسببها اللحوم الفاسدة. وهناك كذلك قلوانيات حيوانية المنشأ أيضاً تتكون في أثناء الحياة، وهي البياضينات أو اللوكومائين Leucoma المشتق اسمها من بياض البيض وهي تختلف عن الشلوينات لأنها تعد من منتجات البدن الحي الطبيعية.
للقلوانيات المختلفة والموجودة في النبات الواحد دائماً بنية كيميائية متقاربة، وهي حقيقة مهمة جداً ومفيدة تسهل تعيين التركيب الكيميائي عند تحديد القلوانيات الرئيسية التي تنتمي عادة إلى الفصيلة النباتية نفسها.
توجد القلوانيات عادة في النباتات مرتبطة مع الحموض بشكل أملاح، فيتحد القلواني مثلاً مع حمض الأوكساليك (حمض الحماض) وحمض اللبن وحمض المالئيك وحمض الطرطير وحمض الليمون... إلخ. ويعتمد محتوى النباتات من القلوانيات على طبيعة التربة والبيئة والفصل، وهي تتوضع غالباً في أجزاء من النبات مثل الحبوب والأوراق والجذور والقشرة. وتستخلص من النباتات عادة بمعالجتها بقلوي مثل هدروكسيد البوتاسيوم، ثم فصلها باستخلاصها بالإيتر أو الكلوروفورم. وقد عُرِفَ ما يقرب من 3000 قلواني. وكان القلواني الأول الذي صنعه لايدنبرغ Ladenburg عام 1886 أبسطها ويدعى كونين conüne، (أو 2 بروبيل ببيريدين C5H10NC3H7)، وهو ذو سمية عالية، إذ إن أقل من 0.2غ منه يقتل الإنسان. يتم الحصول على الكونين من بذور الشوكران hemlock، وهو سم أستخدم في إعدام سقراط. وأكثر سموم هذه المجموعة استخداماً هو الستريكنين وهو سم زعاف، والإنسان أشــد حساسية بالستريكنين من جميع الحيوانات، وهي تختلف من شخص لآخـــر، وإن 0.05غرام من الستريكنين مميت للإنسان الكهل. أما أشد الحيوانات مقاومة للستريكنين فهي الديك والحمام والرخويات. أما الكورار فهو قلواني آخر يسبب الشلل، وقد استخدم لطرد الهنود من أمريكا الجنوبية عن طريق تشريب السهام به، وحمض الليزرجيك LSD، وهو أحد القلوانيات الرئيسية الموجود في فطر الأرغوت (مهماز الشيلم)، الذي يؤدي إلى انفصام الشخصية والهلوسة.
لم يُعرف حتى اليوم دور القلوانيات في النبات على نحو قاطع. وقد افترض هيكل Heckel أن القلوانيات عبارة عن نواتج وسيطة لتشكيل البروتوبلاسما الخلوية. وإذا كانت هذه الفرضية صحيحة فإنها لا تنطبق إلا على القلوانيات التي يكون تركيبها قريباً من الحموض الأمينية. ثبت تجريبياً أن النباتات غير قادرة على تمثل معظم القلوانيات، وبتعبير آخر إذا ما انخفض محتوى النبات من القلواني في أثناء النمو فإنه لن تنتج منه زيادة موافقة في كمية البروتينات. وذهب بعض المؤلفين مثل ايرّيرا Errera إلى افتراض أن القلوانيات تفيـد في حماية النبات، وقد استندت فكرتهم هذه إلى كون القلوانيات مواد موجودة غالباً في الأعضاء المحيطية كالأزهار والثمار وغيرها من النبات. لكن يلاحظ أن القلوانيات لا تحمي النبات من الحيوانات الصغيرة أو الكبيرة على حد سواء. وثمة نظرية مفادها أن للقلوانيات خاصة تنشيط الاستقلاب النباتي، ولكن ذلك لم يثبت تجريبياً بالرغم من وجود مؤشرات عدة تتفق وصحتها.
تبنى بعض العلماء فكرة أن القلوانيات النباتية هي نواتج استقلاب، أي إنها فضلات ناتجة من الاستقلاب الخلوي، وهي بذلك تقوم بتثبيت جزء من الآزوت المطروح، فهي تقوم بدور البولة وحمض البول نفسه عند الحيوانات. غير أن هذه النظرية تفتقر إلى البرهان التجريبي. كما أنه، في الوقت نفسه، يصعب الاقتناع بأن النبات يقوم بصنع جزيء كبير معقد مثل القلوانيات من أجل تثبيت ذرة آزوت واحدة فقط.
وقد اقترح لارسن R.A.Larson، إضافة إلى ما سبق، أن القلوانيات ربما تقوم بدور في حماية النبات من الأكسجين الوحيد 1O2، الذي يسبب بوجود الضوء ضرراً بكل المتعضيات الحية. وقد أظهرت معظم القلوانيات المدروسة هذه الخاصة في تثبيت الأكسجين. لذلك يتوقع المرء أن تتراكم القلوانيات في المناطق ذات الكثافة النباتية العالية والتركيز العالي من الأشعة فوق البنفسجية، وهذا ما يحدث فعلاً.
وإذا كان دور القلوانيات في العالم النباتي لم يحسم بعد، فإن صنع هذه المواد وتوليدها داخل النبات أصبح معروفاً تماماً، فهي تتشـكل من الحموض الأمينية، وإن ألدهيد النمل (ألدهيد فورميك) يقوم حتماً بدور مهم في التصنيع الكيميائي الضوئي للقلوانيات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تصنيف القلويدات

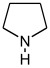
- پيروليدين إنگليزية: Pyrrolidine: هيگرين إنگليزية: hygrine, كوسكوهيگرينإنگليزية: cuscohygrine، نيكوتين إنگليزية: nicotine.
- تروپان إنگليزية: Tropane: أتروپين إنگليزية: atropine، كوكايينإنگليزية: cocaine، إيكگونين إنگليزية: ecgonine، سكوپولامينإنگليزية: scopolamine.
- كينولين إنگليزية: Quinoline: كينينإنگليزية: quinine، كينيدين إنگليزية: quinidine، ديهيدروكينين إنگليزية: dihydroquinine، ديهيدروكينيدين إنگليزية: dihydroquinidine، ستريكنين إنگليزية: strychnine، بروسين إنگليزية: brucine، ڤراترين إنگليزية: veratrine، سڤادينإنگليزية: cevadine.
- إيزوكينولين إنگليزية: Isoquinoline: قلويدات الأفيون إنگليزية: opium morphine, الكودين, إنگليزية: thebaine, هيروين, بابافيرين, ناركوتين, نارسيين, هدراستين, بربرين
- فينيتيل-أمين إنگليزية: Phenethylamine : [[MDMA, إنگليزية: methamphetamine, ميسكالين, إفدرين
- مجموعة إندول :
Main classes of monomeric alkaloids are listed in the table below:
| Class | Major groups | Main synthesis steps | Examples |
|---|---|---|---|
| Alkaloids with nitrogen heterocycles (true alkaloids) | |||
| Pyrrolidine derivatives[2] | Ornithine or arginine → putrescine → N-methylputrescine → N-methyl-Δ1-pyrroline [3] | Hygrine, hygroline, stachydrine[2][4] | |
| Tropane derivatives[5] | Atropine group Substitution in positions 3, 6 or 7 |
Ornithine or arginine → putrescine → N-methylputrescine → N-methyl-Δ1-pyrroline [3] | Atropine, scopolamine, hyoscyamine[2][5][6] |
| Cocaine group Substitution in positions 2 and 3 |
Cocaine, ecgonine [5][7] | ||
| Pyrrolizidine derivatives[8] | Non-esters | In plants: ornithine or arginine → putrescine → homospermidine → retronecine [3] | Retronecine, heliotridine, laburnine [8][9] |
| Complex esters of monocarboxylic acids | Indicine, lindelophin, sarracine [8] | ||
| Macrocyclic diesters | Platyphylline, trichodesmine[8] | ||
| 1-aminopyrrolizidines (lolines) | In fungi: L-proline + L-homoserine → N-(3-amino-3-carboxypropyl)proline → norloline[10][11] | Loline, N-formylloline, N-acetylloline[12] | |
| Piperidine derivatives[13] | Lysine → cadaverine → Δ1-piperideine [14] | Sedamine, lobeline, anaferine, piperine [15][16] | |
| Octanoic acid → coniceine → coniine [17] | Coniine, coniceine [17] | ||
| Quinolizidine derivatives[18][19] | Lupinine group | Lysine → cadaverine → Δ1-piperideine [20] | Lupinine, nupharidin [18] |
| Cytisine group | Cytisine [18] | ||
| Sparteine group | Sparteine, lupanine, anahygrine[18] | ||
| Matrine group | Matrine, oxymatrine, allomatridine[18][21][22] | ||
| Ormosanine group | Ormosanine, piptantine[18][23] | ||
| Indolizidine derivatives[24] | Lysine → δ-semialdehyde of α-aminoadipic acid → pipecolic acid → 1 indolizidinone [25] | Swainsonine, castanospermine [26] | |
| Pyridine derivatives[27][28] | Simple derivatives of pyridine | Nicotinic acid → dihydronicotinic acid → 1,2-dihydropyridine [29] | Trigonelline, ricinine, arecoline [27][30] |
| Polycyclic noncondensing pyridine derivatives | Nicotine, nornicotine, anabasine, anatabine [27][30] | ||
| Polycyclic condensed pyridine derivatives | Actinidine, gentianine, pediculinine [31] | ||
| Sesquiterpene pyridine derivatives | Nicotinic acid, isoleucine [32] | Evonine, hippocrateine, triptonine [28][29] | |
| Isoquinoline derivatives and related alkaloids [33] | Simple derivatives of isoquinoline [34] | Tyrosine or phenylalanine → dopamine or tyramine (for alkaloids Amarillis) [35][36] | Salsoline, lophocerine [33][34] |
| Derivatives of 1- and 3-isoquinolines [37] | N-methylcoridaldine, noroxyhydrastinine [37] | ||
| Derivatives of 1- and 4-phenyltetrahydroisoquinolines [34] | Cryptostilin [34][38] | ||
| Derivatives of 5-naftil-isoquinoline [39] | Ancistrocladine [39] | ||
| Derivatives of 1- and 2-benzyl-izoquinolines [40] | Papaverine, laudanosine, sendaverine | ||
| Cularine group[41] | Cularine, yagonine [41] | ||
| Pavines and isopavines [42] | Argemonine, amurensin [42] | ||
| Benzopyrrocolines [43] | Cryptaustoline [34] | ||
| Protoberberines [34] | Berberine, canadine, ophiocarpine, mecambridine, corydaline [44] | ||
| Phtalidisoquinolines [34] | Hydrastine, narcotine (Noscapine) [45] | ||
| Spirobenzylisoquinolines [34] | Fumaricine [42] | ||
| Ipecacuanha alkaloids[46] | Emetine, protoemetine, ipecoside [46] | ||
| Benzophenanthridines [34] | Sanguinarine, oxynitidine, corynoloxine [47] | ||
| Aporphines [34] | Glaucine, coridine, liriodenine [48] | ||
| Proaporphines [34] | Pronuciferine, glaziovine [34][43] | ||
| Homoaporphines [49] | Kreysiginine, multifloramine [49] | ||
| Homoproaporphines [49] | Bulbocodine [41] | ||
| Morphines[50] | Morphine, codeine, thebaine, sinomenine [51] | ||
| Homomorphines [52] | Kreysiginine, androcymbine [50] | ||
| Tropoloisoquinolines [34] | Imerubrine [34] | ||
| Azofluoranthenes [34] | Rufescine, imeluteine [53] | ||
| Amaryllis alkaloids[54] | Lycorine, ambelline, tazettine, galantamine, montanine [55] | ||
| Erythrite alkaloids[38] | Erysodine, erythroidine [38] | ||
| Phenanthrene derivatives [34] | Atherosperminine [34][44] | ||
| Protopins [34] | Protopine, oxomuramine, corycavidine [47] | ||
| Aristolactam [34] | Doriflavin [34] | ||
| Oxazole derivatives[56] | Tyrosine → tyramine [57] | Annuloline, halfordinol, texaline, texamine[58] | |
| Isoxazole derivatives | Ibotenic acid → Muscimol | Ibotenic acid, Muscimol | |
| Thiazole derivatives[59] | 1-Deoxy-D-xylulose 5-phosphate (DOXP), tyrosine, cysteine [60] | Nostocyclamide, thiostreptone [59][61] | |
| Quinazoline derivatives[62] | 3,4-Dihydro-4-quinazolone derivatives | Anthranilic acid or phenylalanine or ornithine [63] | Febrifugine[64] |
| 1,4-Dihydro-4-quinazolone derivatives | Glycorine, arborine, glycosminine[64] | ||
| Pyrrolidine and piperidine quinazoline derivatives | Vazicine (peganine) [56] | ||
| Acridine derivatives[56] | Anthranilic acid [65] | Rutacridone, acronicine[66][67] | |
| Quinoline derivatives[68][69] | Simple derivatives of quinoline derivatives of 2 - quinolones and 4-quinolone | Anthranilic acid → 3-carboxyquinoline [70] | Cusparine, echinopsine, evocarpine[69][71][72] |
| Tricyclic terpenoids | Flindersine[69][73] | ||
| Furanoquinoline derivatives | Dictamnine, fagarine, skimmianine[69][74][75] | ||
| Quinines | Tryptophan → tryptamine → strictosidine (with secologanin) → korinanteal → cinhoninon [36][70] | Quinine quinidine cinchonine, cinhonidine [73] | |
| Indole derivatives[51] | Non-isoprene indole alkaloids | ||
| Simple indole derivatives [76] | Tryptophan → tryptamine or 5-hydroxitriptofan [77] | Serotonin, psilocybin, dimethyltryptamine (DMT), bufotenin [78][79] | |
| Simple derivatives of β-carboline [80] | Harman, harmine, harmaline, eleagnine [76] | ||
| Pyrroloindole alkaloids [81] | Physostigmine (eserine), etheramine, physovenine, eptastigmine[81] | ||
| Semiterpenoid indole alkaloids | |||
| Ergot alkaloids[51] | Tryptophan → chanoclavine → agroclavine → elimoclavine → paspalic acid → lysergic acid [81] | Ergotamine, ergobasine, ergosine[82] | |
| Monoterpenoid indole alkaloids | |||
| Corynanthe type alkaloids[77] | Tryptophan → tryptamine → strictosidine (with secologanin) [77] | Ajmalicine, sarpagine, vobasine, ajmaline, yohimbine, reserpine, mitragynine,[83][84] group strychnine and (Strychnine brucine, aquamicine, vomicine [85]) | |
| Iboga-type alkaloids[77] | Ibogamine, ibogaine, voacangine[77] | ||
| Aspidosperma-type alkaloids[77] | Vincamine, vincotine, aspidospermine[86][87] | ||
| Imidazole derivatives[56] | Directly from histidine[88] | Histamine, pilocarpine, pilosine, stevensine[56][88] | |
| Purine derivatives[89] | Xantosine (formed in purine biosynthesis) → 7 methylxantosine → 7-methyl xanthine → theobromine → caffeine [36] | Caffeine theobromine theophylline saxitoxin [90][91] | |
| Alkaloids with nitrogen in the side chain (protoalkaloids) | |||
| β-Phenylethylamine derivatives[43] | Tyrosine or phenylalanine → dioxyphenilalanine → dopamine → adrenaline and mescaline tyrosine → tyramine phenylalanine → 1-phenylpropane-1,2-dione → cathinone → ephedrine and pseudoephedrine [32][92][93] | Tyramine, ephedrine, pseudoephedrine, mescaline, cathinone, catecholamines (adrenaline, noradrenaline, dopamine)[32][94] | |
| Colchicine alkaloids [95] | Tyrosine or phenylalanine → dopamine → autumnaline → colchicine [96] | Colchicine, colchamine[95] | |
| Muscarine [97] | Glutamic acid → 3-ketoglutamic acid → muscarine (with pyruvic acid)[98] | Muscarine, allomuscarine, epimuscarine, epiallomuscarine[97] | |
| Benzylamine[99] | Phenylalanine with valine, leucine or isoleucine[100] | Capsaicin, dihydrocapsaicin, nordihydrocapsaicin [99][101] | |
| Polyamines alkaloids | |||
| Putrescine derivatives[102] | ornithine → putrescine → spermidine → spermine[103] | Paucine [102] | |
| Spermidine derivatives[102] | Lunarine, codonocarpine[102] | ||
| Spermine derivatives[102] | Verbascenine, aphelandrine [102] | ||
| Peptide (cyclopeptide) alkaloids | |||
| Peptide alkaloids with a 13-membered cycle [104][105] | Numularine C type | From different amino acids [104] | Numularine C, numularine S [104] |
| Ziziphin type | Ziziphin A, sativanine H [104] | ||
| Peptide alkaloids with a 14-membered cycle [104][105] | Frangulanine type | Frangulanine, scutianine J [105] | |
| Scutianine A type | Scutianine A [104] | ||
| Integerrine type | Integerrine, discarine D [105] | ||
| Amphibine F type | Amphibine F, spinanine A [104] | ||
| Amfibine B type | Amphibine B, lotusine C [104] | ||
| Peptide alkaloids with a 15-membered cycle [105] | Mucronine A type | Mucronine A [106][105] | |
| Pseudoalkaloids (terpenes and steroids) | |||
| Diterpenes [106] | Licoctonine type | Mevalonic acid → izopentenilpyrophosfate → geranyl pyrophosphate [107][108] | Aconitine, delphinine [106][109] |
| Steroids[110] | Cholesterol, arginine[111] | Solasodine, solanidine, veralkamine[112] | |
الخصائص
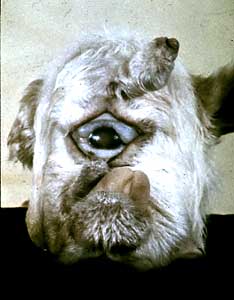
الانتشار في الطبيعة
المفرزات القلوانية
تعد القلوانيات alkaloids أحياناً من المفرزات، وهي مواد بروتيدية تمثل فضلات عمليات الاستقلاب النباتي. لهذه المواد الأمينية القلوية خصائص صيدلانية مهمة، فهي بالغة السمية للإنسان إذا استعملت بتركيز مرتفع. من هذه المركبات التي تضم الفينل ألانين يذكر الايفدرين ephedrine المحاكي للُودي sympathicomimetic المستحصل من نبات الايفيدرا Ephedra ، والهورديئين hordeine رافع الضغط الشرياني المستحصل من الشعير، والكولشيسين colchicine بنزوليّ النواة، مضاد الالتهاب، والمثبط للانقسام الخلوي في مرحلة الطور الثاني.
وتضم أوراق الكوكا Coca نوى البيبيردين piperidine أو البيروليدين pyrrolidine. ويضمّ نبات السوكران Conium maculatum الكونيسيدين conicidine شديد السمية، وفي نبات الخروع يوجد الريسينين ricinine، ويعزى إلى البيبيرين piperine الطعم اللاذع للفلفل، وإلى النيكوتين رائحة التبغ، وإلى الستركنين strychnine والبروسين brucine خواص الجوز المقيئ، و إلى الايرغوتامين ergotamine سمية فطر مهماز الشيلم الذي يحوي نواة أندولية. وتوجد نواة الكينوليك quinoléique في نبات الكينا quinquina، ويمثل الناركوتين narcotine المادة الفعالة في الخشخاش، والأفيون، والبابافيرين. وحول نواة التروبان tropane يتشكّل الأتروبين الموجود في نبات السيدة الحسناء Atropa belladonna وفي غيرها من نباتات الفصيلة الباذنجانية. ويمكن أيضاً ذكر الكوديئين الذي يحوي نواة الفيننانترين، والمنبِّهات المدرّة للبول، مثل الكافيئين الموجود في القهوة، والتيين في الشاي.
الاستخلاص
التخليق الحيوي
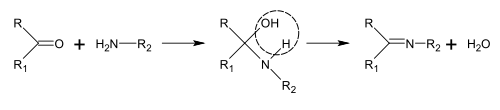
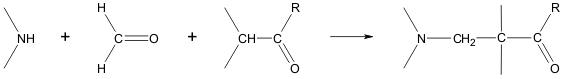
Synthesis of Schiff bases
Schiff bases can be obtained by reacting amines with ketones or aldehydes.[113] These reactions are a common method of producing C=N bonds.[114]
Mannich reaction
The Mannich reaction can proceed both intermolecularly and intramolecularly:[115][116]
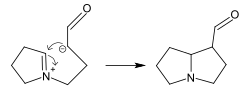
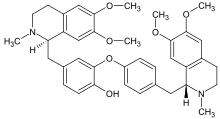
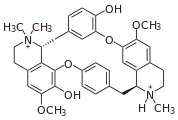
Dimer alkaloids
In addition to the described above monomeric alkaloids, there are also dimeric, and even trimeric and tetrameric alkaloids formed upon condensation of two, three and four monomeric alkaloids. Dimeric alkaloids are usually formed from monomers of the same type through the following mechanisms:[117]
- Mannich reaction, resulting in, e.g., voacamine
- Michael reaction (villalstonine).
- Condensation of aldehydes with amines (toxiferine).
- Oxidative addition of phenols (dauricine, tubocurarine).
- Lactonization (carpaine).
- Voacamine.svg
الاستخدامات
في الطب
Medical use of alkaloid plants has a long history, and thus when the first alkaloids were synthesized in the 19th century, they immediately found application in clinical practice.[118] Many alkaloids are still used in medicine, usually in the form of salts, including the following:[119][120]:
للقلوانيات تأثيرات فيزيولوجية قوية، حتى عندما تكون بتراكيز قليلة جداً. ويوجد منها نحو 30نوعاً تستخدم في الطب، منها الأتروبين، على سبيل المثال، الذي يستخلص من نبات البيلادونا، وهو يسبب توسع حدقة العين، وكذلك مشتق زهر مدغشقر Pervenche de Madagascar (أو ما يدعى Vinca rosea) الذي يستخدم لمعالجة بعض أنواع السرطان، والمورفين المادة المسكنة للألم الفعالة جداً، والكينين الذي هو دواء نوعي للملاريا، والنيكوتين المضاد للحشرات، أما الره زريين فهو مهدئ جيد (انظر المخطط).
| Alkaloid | Action |
|---|---|
| Ajmaline | antiarrhythmic |
| Atropine, scopolamine, hyoscyamine | anticholinergic |
| Vinblastine, vincristine | antitumor |
| Vincamine | vasodilating, antihypertensive |
| Codeine | cough medicine |
| Cocaine | anesthetic |
| Colchicine | remedy for gout |
| Morphine | analgesic |
| Reserpine | antihypertensive |
| Tubocurarine | Muscle relaxant |
| Physostigmine | inhibitor of acetylcholinesterase |
| Quinidine | antiarrhythmic |
| Quinine | antipyretics, antimalarial |
| Emetine | antiprotozoal agent |
| Ergot alkaloids | sympathomimetic, vasodilator, antihypertensive |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
المصادر
- ^ Andreas Luch (2009). Molecular, clinical and environmental toxicology. Springer. p. 20. ISBN 3764383356.
- ^ أ ب ت Plemenkov, p. 224
- ^ أ ب ت Aniszewski, p. 75
- ^ Orekhov, p. 33
- ^ أ ب ت Chemical Encyclopedia: Tropan alkaloids
- ^ Hesse, p. 34
- ^ Aniszewski, p. 27
- ^ أ ب ت ث Chemical Encyclopedia: Pyrrolizidine alkaloids
- ^ Plemenkov, p. 229
- ^ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). "Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids". Chembiochem. 6 (6): 1016–1022. doi:10.1002/cbic.200400327. PMID 15861432.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). "On the sequence of bond formation in loline alkaloid biosynthesis". Chembiochem. 7 (7): 1078–1088. doi:10.1002/cbic.200600066. PMID 16755627.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). "Loline alkaloids: currencies of mutualism". Phytochemistry. 68 (7): 980–996. doi:10.1016/j.phytochem.2007.01.010. PMID 17346759.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Plemenkov, p. 225
- ^ Aniszewski, p. 95
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةref24 - ^ Orekhov, p. 80
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةref25 - ^ أ ب ت ث ج ح Chemical Encyclopedia: Quinolizidine alkaloids
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. - London: The Chemical Society, 1971, p. 93
- ^ Aniszewski, p. 98
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. - London: The Chemical Society, 1971, p. 91
- ^ Joseph P. Michael (2002). "Indolizidine and quinolizidine alkaloids". Nat. Prod. Rep. 19: 458–475. doi:10.1039/b208137g.
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. - London: The Chemical Society, 1971, p. 92
- ^ Dewick, p. 310
- ^ Aniszewski, p. 96
- ^ Aniszewski, p. 97
- ^ أ ب ت Plemenkov, p. 227
- ^ أ ب Chemical Encyclopedia: pyridine alkaloids
- ^ أ ب Aniszewski, p. 107
- ^ أ ب Aniszewski, p. 85
- ^ Plemenkov, p. 228
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةAniszewski 110 - ^ أ ب Hesse, p. 36
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف Chemical Encyclopedia: isoquinoline alkaloids
- ^ Aniszewski, pp. 77–78
- ^ أ ب ت Tadhg P. Begley.Encyclopedia of Chemical Biology: Alkaloid Biosynthesis
- ^ أ ب J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. - London: The Chemical Society, 1973, p. 122
- ^ أ ب ت Hesse, p. 54
- ^ أ ب Hesse, p. 37
- ^ Hesse, p. 38
- ^ أ ب ت Hesse, p. 46
- ^ أ ب ت Hesse, p. 50
- ^ أ ب ت Kenneth W. Bentley (1997). "β-Phenylethylamines and the isoquinoline alkaloids". Nat. Prod. Rep. 14 (4): 387–411. doi:10.1039/NP9971400387. PMID 9281839.
- ^ أ ب Hesse, p. 47
- ^ Hesse, p. 39
- ^ أ ب Hesse, p. 41
- ^ أ ب Hesse, p. 49
- ^ Hesse, p. 44
- ^ أ ب ت J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. - London: The Chemical Society, 1973, p. 164
- ^ أ ب Hesse, p. 51
- ^ أ ب ت Plemenkov, p. 236
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. - London: The Chemical Society, 1973, p. 163
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 3. - London: The Chemical Society, 1973, p. 168
- ^ Hesse, p. 52
- ^ Hesse, p. 53
- ^ أ ب ت ث ج Plemenkov, p. 241
- ^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. - Academic Press, 1989, p. 261
- ^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 35. - Academic Press, 1989, pp. 260–263
- ^ أ ب Plemenkov, p. 242
- ^ Tadhg P. Begley.Encyclopedia of Chemical Biology: Cofactor Biosynthesis
- ^ John R. Lewis (2000). "Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids". Nat. Prod. Rep. 17 (1): 57–84. doi:10.1039/a809403i. PMID 10714899.
- ^ Chemical Encyclopedia: Quinazoline alkaloids
- ^ Aniszewski, p. 106
- ^ أ ب Aniszewski, p. 105
- ^ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). "The biosynthesis of plant alkaloids and nitrogenous microbial metabolites". Nat. Prod. Rep. 16: 199–208. doi:10.1039/a705734b.
- ^ Plemenkov, pp. 231, 246
- ^ Hesse, p. 58
- ^ Plemenkov, p. 231
- ^ أ ب ت ث Chemical Encyclopedia: Quinoline alkaloids
- ^ أ ب Aniszewski, p. 114
- ^ Orekhov, p. 205
- ^ Hesse, p. 55
- ^ أ ب Plemenkov, p. 232
- ^ Orekhov, p. 212
- ^ Aniszewski, p. 118
- ^ أ ب Aniszewski, p. 112
- ^ أ ب ت ث ج ح Aniszewski, p. 113
- ^ Hesse, p. 15
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. - London: The Chemical Society, 1971, p. 467
- ^ Dewick, p. 349-350
- ^ أ ب ت Aniszewski, p. 119
- ^ Hesse, p. 29
- ^ Hesse, pp. 23-26
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 1. - London: The Chemical Society, 1971, p. 169
- ^ J. E. Saxton The Alkaloids. A Specialist Periodical Report. Volume 5. - London: The Chemical Society, 1975, p. 210
- ^ Hesse, pp. 17-18
- ^ Dewick, p. 357
- ^ أ ب Aniszewski, p. 104
- ^ Hesse, p. 72
- ^ Hesse, p. 73
- ^ Dewick, p. 396
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةref31 - ^ PlantCyc Pathway: ephedrine biosynthesis
- ^ Hesse, p. 76
- ^ أ ب Chemical Encyclopedia: colchicine alkaloids
- ^ Aniszewski, p. 77
- ^ أ ب Hesse, p. 81
- ^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 376
- ^ أ ب Hesse, p. 77
- ^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 268
- ^ Arnold Brossi The Alkaloids: Chemistry and Pharmacology, Volume 23. - Academic Press, 1984, p. 231
- ^ أ ب ت ث ج ح Hesse, p. 82
- ^ Spermine Biosynthesis
- ^ أ ب ت ث ج ح خ د خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةref27 - ^ أ ب ت ث ج ح Plemenkov, p. 243
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةref23 - ^ Chemical Encyclopedia: Terpenes
- ^ Tadhg P. Begley.Encyclopedia of Chemical Biology: Natural Products: An Overview
- ^ Atta-ur-Rahman and M. Iqbal Choudhary (1997). "Diterpenoid and steroidal alkaloids". Nat. Prod. Rep. 14 (2): 191–203. doi:10.1039/np9971400191. PMID 9149410.
- ^ Hesse, p. 88
- ^ Dewick, p. 388
- ^ Plemenkov, p. 247
- ^ Plemenkov, p. 254
- ^ Dewick, p. 19
- ^ Plemenkov, p. 255
- ^ Dewick, p. 305
- ^ Hesse, pp. 91–105
- ^ Hesse, p. 303
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMeyers - ^ Hesse, pp. 303-309