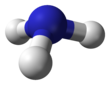
أمونياك
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاكs | |||
| أسماء أخرى
Azane (only intended for use in naming derivatives of ammonia)
Hydrogen nitride R-717 (refrigerant) | |||
| Identifiers | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| مرجع بايلستاين | 3587154 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| رقم EC |
| ||
| مرجع Gmelin | 79 | ||
| KEGG | |||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1005 | ||
| InChI | InChI={{{value}}} | ||
| SMILES | |||
| الخصائص | |||
| الصيغة الجزيئية | NH3 | ||
| كتلة مولية | 17.031 g/mol | ||
| المظهر | Colourless gas | ||
| الرائحة | strong pungent odour | ||
| الكثافة | 0.86 kg/m3 (1.013 bar at boiling point) 0.769 kg/m3 (STP)[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[5] | ||
| قابلية الذوبان | soluble in chloroform, ether, ethanol, methanol | ||
| ضغط البخار | 857.3 kPa | ||
| الحموضة (pKa) | 32.5 (−33 °C),[6] 10.5 (DMSO) | ||
| القاعدية (pKb) | 4.75 | ||
| القابلية المغناطيسية | −18.0·10−6 cm3/mol | ||
| معامل الانكسار (nD) | 1.3327 | ||
| اللزوجة |
| ||
| البنية | |||
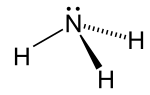
| الشكل الجزيئي | Trigonal pyramid | ||
| Dipole moment | 1.42 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−46 kJ·mol−1[8] | ||
| Standard molar entropy S |
193 J·mol−1·K−1[8] | ||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 0414 (anhydrous) | ||
| ن.م.ع. مخطط تصويري |    [9] [9]
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H290, H301, H311, H314, H330, H334, H336, H360, H362, H373, H400 | |||
| P202, P221, P233, P261, P263, P271, P273, P280, P305+P351+P338, P310[9] | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 132 | ||
| 651 °C (1,204 °F; 924 K) | |||
| حدود الانفجار | 15–28% | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
0.015 mL/kg (human, oral) | ||
LC50 (التركيز الأوسط)
|
40,300 ppm (rat, 10 min) 28,595 ppm (rat, 20 min) 20,300 ppm (rat, 40 min) 11,590 ppm (rat, 1 hr) 7338 ppm (rat, 1 hr) 4837 ppm (mouse, 1 hr) 9859 ppm (rabbit, 1 hr) 9859 ppm (cat, 1 hr) 2000 ppm (rat, 4 hr) 4230 ppm (mouse, 1 hr)[10] | ||
LCLo (المنشورة الأقل)
|
5000 ppm (mammal, 5 min) 5000 ppm (human, 5 min)[10] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH):[11] | |||
PEL (المسموح)
|
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) | ||
REL (الموصى به)
|
TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) | ||
IDLH (خطر عاجل)
|
300 ppm | ||
| مركبات ذا علاقة | |||
كاتيونات أخرى
|
Phosphine Arsine Stibine Bismuthine | ||
nitrogen hydrides ذات العلاقة
|
Hydrazine Hydrazoic acid | ||
مركـّبات ذات علاقة
|
Ammonium hydroxide | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الأمونياك أو غاز النشادر هو غاز قلوي لالون له. يتشكل من جزء نتروجين واحد و ثلاثة أجزاء هيدروجين، و هو أخف من الهواء و له رائحة نفاذة مميزة. الرمز الكيمائي له هو NH3 ويحضر بتقطير الفحم أو بعض المواد النيتروجينيه، يمكن إستنشاق غاز الأمونياك إذا كان مخففا بشكل كبير في الهواء، و لكنه قد يؤدي إلى الإختناق و الموت إذا كان مركز. و لا يشتعل غاز الأمنياك في الهواء ، و لكنه يشتعل في الأكسجين و يحدث لهبا أصفر ضعيف.
الصيغة البنائية:
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- الأمونياك شديد الذوبان في الماء. و يشكل محلولا يعرف بإسم هيدروكسيد الأمونيوم NH4OH ،و الأمونياك ليس فعالا بدرجة كبيرة عندما يكون جافا ولكن عندما يذوب يتفاعل مع الكثير من المواد الكيميائية. يعادل هيدروكسيد الأمونيوم العديد من الأحماض و يشكل أملاح الأمونيوم المقابلة. مثلا إذا أضيف حمض الهيدروكلوريك ( HCL) إلى هيدرو كسيد الأمونيوم ( NH4OH) ينتج محلول كلوريد الأمونيوم NH4CL حسب المعادلة:
NH4OH + HCl → NH4Cl + H2O
- يتحول الأمونياك إلى سائل عند 33.35 -°م. و يغلي سائل الأمونياك في نفس درجة الحرارة، و يتجمد و يتحول إلى مادة صلبة صافية عند 77.7-°م و في تحوله من سائل إلى غاز مرة أخرى يمتص الأمونياك قدرا كبيرا من الحرارة من المحيط الخارجي، بحيث يمتص الغرام الواحد من الأمونياك 327 سعرا حراريا. و لهذا السبب الأمونياك يستعمل بشكل واسع في أجهزة التبريد. يمكن اكتشاف تنفيس هذه الماده بحاسة الشم ويحد مكان التنفيس باشعال اصابع مادة الكبريت بالقرب من المكان المشكوك وجود تنفيس به فيظهر دخان أبيض في حالة وجود تنفيس. تختلط الامونياك تماماً مع زيوت التزييت.
التحضير
تحضيره في المخبر
يتم تحضير الأمونياك في المختبر بتسخين أحد أملاح الأمونيوم مع هيدروكسيد الصوديوم. و يمكن أن يعرف غاز الأمونياك من رائحته و بقدرته على تحويل ورق دوار الشمس الرطب من الأحمر إلى الأزرق. مثلا يمكن يمكن تحضيره بتسخين كلوريد الأمونيوم مع الجير المطفي الجاف أو NaOH
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 +2H2O
تحضيره في الصناعة
يتم تحضير الأمونياك في الصناعة بطريقتين :
- طريقة السياناميد
يحضر الأمونياك بهذه الطريقة بمفاعلة كربيد الكالسيوم CaC2 المسحوق والمسخن إلى 1100 درجة مئوية مع غاز النيتروجين، فيتكون سياناميد الكالسيوم CaCN2 الممزوج بالجرافيت.
CaC2 +N2 → CaCN2 + C
وبتسخين سياناميد الكلس مع الماء تحت ضغط مرتفع، يتكون غاز النشادر وكربونات الكالسيوم.
CaCN2 + 3H2O → CaCO3 + 2NH3
- تفاعل هابر-بوش
وهي الأهم صناعيا وتجري عن طريق التفاعل المباشر بين النتروجين والهيدروجين عند ضغوط مرتفعة بوجود حفاز.
إن كلا من الغازين يمكن الحصول عليهما بسهولة ورخص. يتم مزج حجم واحد من النتروجين مع ثلاثة حجوم من الهيدروجين تحت ضغط مرتفع ودرجة حرارة عالية (300 ضغط جوي، 475°م) و بوجود حفاز من أكسيد الحديد المنشط ببعض أكسيد المعادن مثل: أكسيد الألومنيوم هذا و تزداد نسبة الأمونياك بازدياد الضغط وانخفاض درجة الحرارة.
كما يمكن الحصول على الأمونياك كمنتج ثانوي أثناء إنتاج الفحم الحجري و غاز الكوك.
الاستعمالات
- يستخدم الأمونياك بشكل واسع كسمادا مخصبا. و تعتبر نترات الأمونيوم وأملاح الأمونيوم الأخرى أسمدة جيدة و تساعد في زيادة إنتاج المحصول لأنها تحتوي على نسبة عالية من النتروجين. في بعض المناطق الزراعية يتم الأن استعمال الأمونياك اللامائي (الامونيا اللامائية)، وذلك من خزانات كبيرة تحتوي على غاز الأمونياك المضغوط. (وتقدر الكمية المستعملة من الأمونياك في صناعة الأسمدة ب 75% من إنتاج الأمونياك) ومن أهمها سماد اليوريا.
- تتم أكسدة كميات كبيرة من الأمونياك لصناعة حمض النتريك الذي يدخل في العديد من الصناعات المهمة.
- كما يستخدم أيضا في صبغ وتنظيف القطن والصوف و ليف الألياف النسيجية الأخرى. ويستخدم ماء الأمونياك كسائل منظف أحيانا.ويمكن أن يستعمل أيضا في تنظيف الأنسجة الملطخة بالحموض.
- يعتبر الأمونياك شيئا جوهريا في صناعة الكثير من المواد الكميائية و البلاستكية و الفيتامينات و العقاقير. مثلا يقوم الأمونياك بدور العامل الحافز في صناعة مواد بلاستيكية مثل: الراتنج الصناعي ،راتنج الميلامين.
المراجع
- ^ "NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005" (PDF).
- ^ "Gases – Densities". Retrieved 3 March 2016.
- ^ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 978-1-4067-7302-6.
- ^ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. doi:10.1080/00337577508240819.
- ^ Budavari, Susan, ed. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.). Merck. ISBN 978-0-911910-12-4.
- ^ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ^ Iwasaki, Hiroji; Takahashi, Mitsuo (1968). "Studies on the transport properties of fluids at high pressure". The Review of Physical Chemistry of Japan. 38 (1).
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ أ ب Sigma-Aldrich Co., Ammonia. Retrieved on 20 July 2013.
- ^ أ ب "Ammonia". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards 0028