كلورات الصوديوم
| |

| |
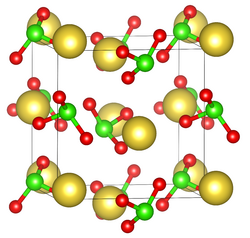 Unit cell of sodium chlorate
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Sodium chlorate
| |
| أسماء أخرى
Sodium chlorate(V)
| |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.989 |
| رقم EC |
|
| KEGG | |
| عناوين مواضيع طبية MeSH | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 1495, 2428 |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | NaClO3 |
| كتلة مولية | 106.44 g mol−1 |
| المظهر | Colorless or white solid, hygroscopic |
| الرائحة | Odorless |
| الكثافة | 2.49 g/cm3 (15 °C)[1] 2.54 g/cm3 (20.2 °C)[2] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 79 g/100 mL (0 °C) 89 g/100 mL (10 °C) 105.7 g/100 mL (25 °C) 125 g/100 mL (40 °C) 220.4 g/100 mL (100 °C)[3] |
| قابلية الذوبان | Soluble in glycerol, hydrazine, methanol Slightly soluble in ethanol, ammonia[1] |
| قابلية الذوبان في acetone | Sparingly soluble[1] |
| قابلية الذوبان في glycerol | 20 g/100 g (15.5 °C)[1] |
| قابلية الذوبان في ethanol | 14.7 g/100 g[1] |
| ضغط البخار | <0.35 mPa[2] |
| القابلية المغناطيسية | −34.7·10−6 cm3/mol |
| معامل الانكسار (nD) | 1.515 (20 °C)[4] |
| البنية | |
| البنية البلورية | cubic |
| ثابت العقد | a = 6.57584 Å |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-365.4 kJ/mol[1] |
| Standard molar entropy S |
129.7 J/mol·K[1] |
| سعة الحرارة النوعية، C | 104.6 J/mol·K[1] |
| المخاطر | |
| صفحة بيانات السلامة | ICSC 1117 |
| ن.م.ع. مخطط تصويري |    [5] [5]
|
| ن.م.ع. كلمة الاشارة | Danger |
| H271, H302, H411[5] | |
| P220, P273[5] | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
600 mg/kg (rats, oral) 700 mg/kg (dogs, oral)[1] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
برومات الصوديوم يودات الصوديوم |
كاتيونات أخرى
|
كلورات الأمونيوم كلورات البوتاسيوم كلورات الباريوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كلورات الصوديوم هو مركب كيميائي له الصيغة NaClO3 ، يكون على شكل بلورات عديمة اللون والرائحة، أو على شكل مسحوق بلوري أبيض.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
ينحل مركب كلورات الصوديوم بشكل جيد جداً بالماء 100 غ / 100 مل ماء، كما أنه ينحل بشكل جيد أيضاً بالغليسيرين، لكنه ضعيف الانحلال بالإيثانول.
وجود كلوريد الصوديوم يقلل من انحلالية كلورات الصوديوم بالماء بشكل كبير.
التحضير
يحضر كلورات الصوديوم عملياً بالتحليل الكهربائي لمحلول مركز من كلوريد الصوديوم في خلايا تحليل كهربائي لا تحوي على حجاب (Diaphragm) أو غشاء (Membrane) بين كل من قطبي الخلية الأنود والكاثود، بحيث أن غاز الكلور المتشكل عند الأنود يتفاعل بشكل مباشر مع شوارد (أيونات) الهيدروكسيل، فينتج لدينا كلورات الصوديوم بالإضافة إلى هيبوكلوريت الصوديوم وذلك حسب التفاعلات التالية
نتيجة وجود شوارد الصوديوم في المحلول نحصل على كلورات الصوديوم.
الاستخدامات
- يستخدم بشكل واسع في عمليات التبييض في صناعة الورق.
- يستخدم لتحضير كلوريت الصوديوم ولتحضير الكلورات الأخرى مثل كلورات البوتاسيوم.
انظر أيضاً
المصادر
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- ^ أ ب ت ث ج ح خ د ذ "Sodium chlorate".
- ^ أ ب "GPS Safety Summary of Sodium Chlorate" (PDF). arkema.com. Arkema. Retrieved 2014-05-25.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةpubchem - ^ أ ب ت Sigma-Aldrich Co., Sodium chlorate. Retrieved on 2022-02-21.
- "Chlorate de potassium. Chlorate de sodium", Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.


