قصدير
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| فضي (يسار، بيتا) أو رمادي (يمين، ألفا) ملف:Sn-Alpha-Beta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | قصدير tin, Sn, 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النطق | /ˈtɪn/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز فقير | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14, 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الوزن الذري القياسي | 118.710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Kr] 4d10 5s2 5p2 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | (أبيضا) 7.365 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | (رمادي) 5.769 گ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 6.99 گ·سم−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 505.08 ك, 231.93 °C, 449.47 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2875 ك, 2602 °س, 4716 °ف | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | (أبيض) 7.03 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | (أبيض) 296.1 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية المولية | (أبيض) 27.112 ج·مول−1·ك−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حالات الأكسدة | 4, 2, -4 (amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سالبية كهربية | 1.96 (مقياس پولنگ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأولى: 708.6 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثانية: 1411.8 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالثة: 2943.0 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري | 140 پم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | Tetragonal (أبيض), diamond cubic (رمادي) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | (رمادي)diamagnetic[1], (رمادي) paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقاومية الكهربائية | (0 °C) 115 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ناقلية حرارية | 66.8 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | (25 °س) 22.0 µm·م−1·ك−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل ينگ | 50 گپا | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 18 گپا | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 58 گپا | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة پواسون | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 51 مپا | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم تسجيل كاس | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: [[نظائر قصدير tin]] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خطأ لوا في وحدة:Navbar على السطر 58: Invalid title Infobox قصدير<br> tin. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
القصدير Tin، هو فلز رمزه الكيميائي Sn وهو موجود في الفصيلة IVA (أو 14) في الجدول الدوري، وتضم الفصيلة، عدا القصدير، عناصر الكربون والسيلسيوم والجرمانيوم والرصاص. تحوي الطبقة الإلكترونية الخارجية لهذه العناصر أربعة إلكترونات موزعة بالشكل ns2np2. ويتميز عنصرا الكربون والسيلسيوم بعدم وجود إلكترونات في المدار d خلاف بقية عناصر الفصيلة التي تكون فيها المدارات (n-1) d مشبعة. تزداد الخواص المعدنية بالانتقال من أعلى الفصيلة إلى أسفلها، لذا يكوِّن القصدير بعض المركبات الأيونية (الشاردية). للقصدير درجتا أكسدة +2 و+4 في مركباته وهما متعادلتان من حيث الثبات، وكمونه النظامي (إلى Sn+2) يساوي (- 136و.) فلط أي إن هذا المعدن مرجِع أقوى من الهيدروجين.
تميل عناصر الفصيلة إلى تكوين سلاسل ناتجة من الترابط بين ذرات العنصر نفسه، وهذه الظاهرة واضحة جداً في الكربون ثم تتناقص حسب الترتيب:
C >>Si>>Ge ≈ Sn>>Pb
ويعود السبب في اختلاف ميل ذرات العنصر نفسه إلى تشكيل سلاسل، بشكل جزيء، إلى الاختلاف في طاقة الترابط بين ذرات العنصر نفسه إذ تتناقص هذه الطاقة من الكربون إلى الرصاص.
وهو أحد الفلزات الأولي في حياة الأنسان و يستخلص من معدن رئيسي يسمي الكاسيترايت ويمتاز هذا الأخير بمقاومته العالية للتغيرات الجوية خلال العصور الجيولوحية. حتى أنه عثر عليه في أقدم أنواع الحصي ما زال علي حالته الأصلية و قد حصل الانسان علي القصدير قبل تمكنه من صهر الحديد بمدة طويلة اذ أنه من اليسير اختزال اكسيد القصدير (الكاسيترايت) إلى الفلز (القصدير) بواسطة التسخين مع الفحم الخشبي في افران بدائية من الحجر والطفل. و سبك القصدير مع النحاس يعطي البرونز الذي هو أصلب من القصدير و من النحاس. وربما كان للصدفة دورها في اكتشاف البرونز القديم (88% نحاس و 22% قصدير).
القصدير عنصر كيميائي رمزه Sn. وهو فلز أبيض اللون يستخدمه الناس منذ العصور القديمة. بدأ أول استخدام معروف للقصدير عام 3500 ق.م. في مدينة أور جنوبي بلاد ما بين النهرين. (العراق حالياً). كان أهل أور يصنعون الأشياء من البرونز، الذي هو سبيكة من القصدير والنحاس. وفي الوقت الحاضر، يستخدم القصدير أساساً في إنتاج الصفائح وهي فولاذ مطلي من الجهتين بطبقة رقيقة من القصدير. يتم تحويل الصفائح الفولاذية المقصدرة إلى علب معدنية لحفظ المأكولات والمنتجات الأخرى. والعدد الذري للقصدير 50، ووزنه الذري 118,71. وتبلغ كثافة القصدير 7,2984جم/سم§ عند 20°م. انظر: الكثافة. والفرق بين درجة انصهاره، 231,9°م، ودرجة غليانه، 2270م، أكبر من أي فلز آخر. وإضافة إلى ذلك فإن القصدير مطاوع جدًا، بمعنى أنه يتميز بقابلية للطرق ويمكن تشكيله بسهولة إلى أشكال معقدة. وتتيح مثل هذه الخصائص وغيرها إمكانية استخدام القصدير في صناعة مجموعة كبيرة من المنتجات.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
وجوده في الطبيعة
الكاسيتيريت cassiterite (SnO2) أهم فلزات القصدير، والقصدير من العناصر النادرة، ولا تتجاوز نسبته في الصخور البركانية 2.1 جزء بالمليون، ولكن توضعاته صالحة للاستحصال اقتصادياً. استحصاله من فلزاته سهل نسبياً ولذلك عرف استعماله منذ القديم. جاء رمزه Sn من اسمه باللاتينية stannum. استحصل السومريون القصدير واستعملوه في بيوتهم جنوبي إيران في عصور ما قبل التاريخ على شكل البرونز. والبرونز سبيكة (خليطة أو أشابة) تحوي 75ـ92% نحاس و8ـ25% قصدير، ولا تزال تستعمل حتى الوقت الحالي في صنع النواقيس والنقود والدوامات...) ويعود استعمال البرونز في مصر إلى نحو 2500سنة قبل الميلاد. وقد عرف اليونان والرومان ضروب البرونز واستحصلوها بتسخين فلزات نحاسية وفلزات قصديرية معاً، فكان فلز النحاس يجلَب من قبرص، والكاسيتيريت من إنكلترا، وبتسخين SnO2 مع الفحم الخشبي المتوهج بفعل الحرارة الشديدة ينتج القصدير: (المعادلة 1 من جدول المعادلات).
ولايزال القصدير يستحصل بالطريقة نفسها بطريقة تشبه كثيراً استحصال الحديد بالفرن اللافح. وتكون نسبة القصدير النقي المستحصل بهذه الطريقة 99.5%. وللحصول على قصدير أنقى تزال الشوائب منه بالتحليل الكهربائي.
البنية الإلكترونية للقصدير [Kr]4d105s25p2، تدل [Kr] على البنية الإلكترونية للغاز الخامل الكريبتون. عدده الذري 50 ووزنه الذري 118.69 ودرجة انصهاره 231.9 ْس ودرجة غليانه 2270 ْس.
تعرف للقصدير حالتان بلوريتان (متآصلان) allotropes α وβ. القصدير α صلب رمادي له بنية الماس، كتلته الحجمية 5.77 ج/سم3، أما الحالة β فهي ثابتة عند درجة حرارة تفوق 13.32ْس وكتلته الحجمية 7.29 ج/سم3، وهذا هو القصدير الأبيض الفضي العادي، وهو ذو بنية رباعية الشبكة tetragonal. وفي درجات الحرارة أعلى من 161ْس، يصبح القصدير هشاً قابلاً للسحق.
معدن القصدير مقاوم للتآكل، ولهذا يستعمل نحو 40% من المعدن المنتَج عالمياً لتغطية سطوح بقية المعادن، مثال ذلك علب الحديد. وتراوح سماكة الطلاء القصديري بين 0.0004و0.025مم. وتحصل التغطية إما بغمس الشيء المراد طلاؤه في القصدير المصهور، وإما بطريقة الطلي الغلڤاني [ر. الكيمياء الكهربائية]. ويستخدم القصدير أيضاً طلاءً للزجاج في صناعة المرايا، وفي تحضير أنواع عدة من السبائك.
ويبيِّن الجدول التالي تركيب سبائك القصدير مع المعادن الأخرى، ومجالات استعمالها، علماً أن البرونز أقدم سبائكه.
| العناصر % | قصدير Sn | أنتموان Sb | رصاص Pb | نحاس Cu | بزموت Bi | مجالات الاستخدام |
|---|---|---|---|---|---|---|
| السبيكة | 90 | 7 | 3 | صناعة قطع ميكانيكية | ||
| سبيكة مقاومة للتآكل والاحتكاك | 75 | 12.5 | 12.5 | صناعة قطع ميكانيكية | ||
| سبيكة اللحام | 33ـ60 | 40ـ66 | صناعة اللحام والإلكترونيات | |||
| سبيكة الطباعة | 26 | 15 | 58 | 1 | الطباعة | |
| سبيكة روز Rose | 22.9 | 27.1 | 50 | سبائك ذات نقاط انصهار منخفضة | ||
| سبائك مستعملة في صنع التحف | 82 | 18 | الفنون الجميلة |
يمكن تحويل القصدير في الحالة bβ بسبب ليونته إلى صفائح رقيقة جداً تدعى ورق القصدير، وهو ناقل جيد للتيار الكهربائي؛ لذلك يستعمل في صنع الفواصم الكهربائية fuses.
وللقصدير، بين العناصر جميعاً، أكبر عدد من النظائر الطبيعية تراوح أعدادها الكتلية بين 112و124.
الخواص الكيميائية
لا يتأثر القصدير بالهواء إلا بتسخينه لدرجة الاحمرار. ولفلز أكسيد القصدير SnO2 استعمالات عديدة كصناعة السيراميك والمواد الملوِّنة، إضافة إلى كونه مصدراً للمعدن. كما يكوّن القصدير الأكسيد SnO. والأكسيدان كلاهما مذبذبان وليسا أساسيين، فالأكسيد SnO يذوب في الحمض وفي القلوي.
يحضر هيدروكسيد القصدير II وهيدروكسيد القصدير IV بتأثير الأسس على محاليل الأملاح نظراً لعدم تفاعل أكسيديه مع الماء.
وتترسب الهدروكسيدات Sn(OH)2 و Sn(OH)4 على شكل رواسب لا بلورية بيضاء اللون. وهدروكسيداه ضعيفا الانحلال في الماء ولكليهما خواص مذبذبة (أمفوتيريه). ينحل Sn(OH)2 و Sn(OH)4 في المحاليل الحمضية وتتكوّن أملاح تحتوي على الأيونات M+2+وM+4 كما تتفاعل هذه الهدروكسيدات مع المحاليل الأساسية مكوِّنة أملاحاً توافق الحمضين H2SnO2 و H4SnO4.
ينتج SnCl2 كلوريد القصدير II من تفاعل القصدير المسخن مع غاز كلوريد الهدروجين، وينحل هذا الملح في الماء وفي محلات عدة أخرى مثل الكحول والأسيتون والإيتر وغيرها.
يمكن لكلوريد القصدير بدرجة الأكسدة (+2) SnCl2 أن يقوم بإرجاع (اختزال) بعض الأيونات المعدنية مثل الفضة والذهب والزئبق ويحولها إلى معدن حر، كما أنه يرجع أملاح الحديد III إلى الحديد II.
يستعمل SnCl2 كاشفاً في الكيمياء التحليلية، كما أنه يستخدم في الصناعة الكيمياوية عامل إرجاع لمواد عضوية عدة. ويعرف للقصدير أيضاً الهاليدات SnF2 و SnBr2 و SnI2 ولها، بصورة عامة، السلوك الكيمياوي لكلوريد القصدير II.
يُبخ كلوريد القصدير IV على القوارير الزجاجية المصنوعة حديثاً، حيث تتوضع طبقة رقيقة منه على السطح نظراً لحلمهة الكلوريد. ويتم بذلك طلي سطحها بغشاء رقيق.
يحضّر هدريد القصدير SnH4 بتفاعل الهدروجين مع المعدن مباشرة. درجة غليانه -52.5ْس، وهو يتفكك بسرعة بالتسخين (ولو عند الدرجة صفر سلسيوس) وينتج القصدير β. وهو يتأكسد بسهولة ولهذا يستعمل مرجعاً في الكيمياء العضوية. (يرجع C6H5CHO إلى C6H5CH2OH ويرجع C6H5NO2 إلى C6H5NH2).
يشكل القصدير مركبات كبريتية من نوع SnS و SnS2. ينحل SnS2 في كبريتيد الأمونيوم وينتج ثلاثي ثيو القصدير IV
يحضر كبريتيد القصدير SnS بتسخين المعدن في بخار الكبريت عند الدرجة 900 ْس، كما يمكن تحضيره بتمرير غاز كبريتيد الهدروجين H2S في محاليل أملاح القصدير II. وهو جسم صلب كستنائي اللون يتبلور حسب النظام المعيني، كتلته الحجمية 5.27غ/سم3، ينصهر عند الدرجة 882 ْس.
وتعرف للقصدير أملاح كبريتات SnSO4 و Sn(SO4)2، ويحضّران بتفاعل SnO أو SnO2 مع حمض الكبريت H2SO4.
ينتج من تفاعل HNO3 الممدد مع القصدير مزيج من الملحين Sn(NO3)2 و Sn(NO3)4.
مركباته العضوية
للقصدير بدرجتي أكسدته +2 و+4 مركبات عضوية عدة. ولمركبات القصدير مع الألكيل، خاصة، أهمية تجارية.
فضروب الألكيلات التي يكوِّنها القصدير II ذات الصيغة SnR2 معروفة منذ القديم وهي ذات بنية معقدة لاتدل عليها صيغتها البسيطة. وقد تم حديثاً استحضار مركبات صيغتها ـ فعلاً ـ SnR2 عندما تكون R فيها زمرة ضخمة مثل (SiMe3)2CH. وهذه المركبات ذات الزمرة الضخمة لونها غامق في المحاليل أو في الحالة الغازية وذات لون أفتح في الحالة البلورية (ويفتح لون البلورات بالتبريد، ويزول اللون عند الدرجة 77ْكلڤن تقريباً). وفي الحالة البلورية تكون هذه المركبات على شكل متماثرات ثنائية يتم الربط بينها بالرابطة Sn–Sn. ويكوّن القصدير II مركبات عضوية مع زمر حلقية، مثال ذلك المركب ذو الصيغة (M–C5H5)2Sn.
أما القصدير IV فالصيغة العامة لمركباتهR4-- nSnXn ءn) تراوح بين صفر و3)، حيث R أريل أو ألكيل و X ذرة أو زمرة (قد تكون H أو هالوجين أو OR´,Mn(CO)5,SR´,NR´2 أو غير ذلك) ومركبات القصدير هذه أكثر فعالية من مثيلاتها مركبات العناصر الأخرى في الفصيلة IV.
ويكوِّن القصدير مركبات صيغتها R3SnX وR2SnX. ويكوِّن القصدير أيضاً مركبات كثيرة نسبياً R2SnX2 و R3SnX سلسلية حلقية أوخطية، وثابتة. فــهو يكوِّن، على سبيل المثال، [Sn(CH3)2]n وذلك بتفاعل الصوديوم في النشادر السائل مع Sn(CH3)2Cl2. وهذا المركب مؤلف من جزيئات على شكل سلسلة خطية، وعدد الجزيئات في السلسلة يراوح بين 12و20 (أو أكثر)، كما يكوِّن في الوقت نفسه مركباً واحداً، على الأقل، ذا بنية حلقية صيغته [Sn(CH3)2]n. وتجري تفاعلات مماثلة لمركبات أريلية أو ألكيلية أخرى.[2]
مركبات هدريد القصدير العضوية ذات الصيغة R3SnH تستحضر بإرجاع الهاليد بالمرجِع LiAlH4 أو بطرق أخرى، وهي تستعمل مواد مرجِعة في الكيمياء العضوية، كما تقوم بتفاعلات ضم مع الألكينات alkynes والألكنات alkenes مثل التفاعل:
وهذه التفاعلات تفيد في استحضار مركبات عضوية جديدة للقصدير.
لمركبات القصدير العضوية استعمالات أكثر من أي مركبات عضوية لمعدن آخر، فالمركب R2SnX2 يستعمل مثبتاً لكلوريد البولي ڤينيل polyvinyl chloride، ويستعمل أكسيد ثلاثي بوتيل القصدير حافظاً للخشب، كما تقوم هذه المركبات بدور الوساطة (الحفز)، ومبيدات للفطور.
الاستعمالات
تعمل الطبقة الخارجية الموجودة على علب القصدير على حماية الفولاذ في العلب من الصدأ، كما أنها تقدم شكلاً جذابًا. ويمنع القصدير كذلك الحموض الضعيفة في الطعام من إتلاف محتويات العلب. انظر: علبة الصفيح.
تعمل طبقات القصدير الخارجية أيضاً على حماية الكثير من الأصناف الأخرى. فمعظم مشابك الورق ودبابيس الأمان، والدبابيس المستقيمة، ودبابيس الدباسة مصنوعة من النحاس المطلي بالقصدير. كما تحتوي كثير من أوعية إعداد الطعام والأواني على طبقات خارجية من القصدير.
ويتمثل الاستخدام الثاني الكبير الأهمية للقصدير في سبائك اللحام التي هي خليط يستخدم في لحام الأسطح الفلزية. ويطلق على سبائك اللحام المصنوعة أساساً من القصدير والرصاص اسم سبائك اللحام الرخوة أو اللينة؛ و هي تنصهر عند درجات حرارة منخفضة نسبياً. وتشمل سبائك القصدير الأخرى البرونز والبيوتر. انظر: اللحام؛ البرونز؛ البيوتر، سبيكة.
منجم قصدير قرب كوالا لامبور يزود بخام القصدير للتنقية. وماليزيا واحدة من الدول الرئيسية المنتجة للقصدير في العالم.
وتسمح قابلية طرق القصدير للصناع بتحويل القصدير إلى رقائق رهيفة. وتستخدم مثل هذه الرقائق في التغليف المضاد للرطوبة. والفولاذ المقصدر حديد مغلف بسبيكة من الرصاص والقصدير. وتستخدم ألواح أو شرائح الفولاذ المقصدر في صناعة الأسقف وفي منتجات أخرى مثل خزانات الوقود وطفايات الحريق.
ويحسّن الصناع من خصائص فلزات متعددة بإضافة كميات قليلة من القصدير. فالحديد الزهر الذي يحتوي على 0,1% فقط من القصدير مثلاً، أكثر متانة وأسهل تشكيلاً من الحديد الزهر العادي. وكذلك تحتوي كثير من المنتجات الأخرى التي تشمل المحامل وحشوات الأسنان وسبائك الطباعة على كميات من القصدير تحسن من خصائصها.
ويتحد القصدير مع عناصر أخرى لتكوين عدد كبير من المركبات المفيدة. فكثير من معاجين الأسنان تحتوي على فلوريد القصديروز، وهو مركب من القصدير والفلور يساعد على منع تسوس الأسنان. وتستخدم مركبات معينة تحتوي على القصدير والكربون مبيدات حشرية.
مناطق وجود القصدير
يشكل القصدير 0,001% تقريباً من القشرة الأرضية. ونتيجة لذلك فإن كمية القصدير التي يتم استخراجها من المناجم صغيرة جدًا مقارنة بالفلزات الشائعة الأخرى. وتوجد معظم ترسبات القصدير المعروفة في نصف الكرة الجنوبي. وخام القصدير الأساسي مركب من القصدير والاكسجين يسمى أكسيد القصدير. انظر: أكسيد القصدير. ويحتوي بعض خام القصدير على الكبريت وكميات قليلة من فلزات أخرى مثل النحاس والحديد والرصاص.
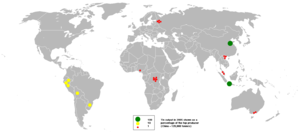
تتكون رواسب القصدير أحياناً من العروق الضيقة الممتدة في الجرانيت. ومع ذلك يوجد معظم خام القصدير في السهول، حيث ترسب المياه الجارية مقادير ضئيلة من الجرانيت المتفتت والخام. وتعتبر الصين أكبر منتج في العالم. وتشمل الدول المهمة الأخرى المنتجة للقصدير البرازيل وبوليفيا وبيرو والبرتغال وماليزيا وأستراليا وروسيا وفيتنام.
| البلد | الاحتياطياات | الاحتياطي الأساسي |
|---|---|---|
| 1,700,000 | 3,500,000 | |
| 1,000,000 | 1,200,000 | |
| 710,000 | 1,000,000 | |
| 800,000 | 900,000 | |
| 540,000 | 2,500,000 | |
| 450,000 | 900,000 | |
| 300,000 | 350,000 | |
| أخرى | 180,000 | 200,000 |
| 170,000 | 250,000 | |
| 150,000 | 300,000 | |
| NA | NA |
| تقديرات الاستخدامات الاقتصادية لاحتياطيات العالم من القصدير (بالمليون طن)[3] | |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2008 | 6,100[4] |
| الانتاج التراكمي العالمي للقصدير (بالطن)[5] | ||
|---|---|---|
| 1850 | 2,000 | 2,000 |
| 1925 | 5,500 | 7,500 |
| 1970 | 7,659 | 15,159 |
| 2006 | 8,274 | 23,433 |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تنقية القصدير
يتم إنتاج القصدير بتسخين أكسيد القصدير مع الفحم الحجري والحجر الجيري في فرن خاص. وبعد هذه العملية المعروفة بالصهر، تتم تنقية القصدير ـ عادة إلى درجة نقاء تبلغ 99,8%. للحصول على تفاصيل أكثر عن التنقية، انظر: الفلزات، علم. ويمزج معظم القصدير ويصب في سبائك (قطع مستطيلة) زنة كل منها 45كجم.
| البلد | انتاج الفلز | انتاج المصهر |
|---|---|---|
| الصين | 114,300 | 129,400 |
| إندونسيا | 117,500 | 80,933 |
| پيرو | 38,470 | 40,495 |
| بوليڤيا | 17,669 | 13,500 |
| تايلند | 225 | 27,540 |
| ماليزيا | 2,398 | 23,000 |
| بلجيكا | 0 | 8,000 |
| روسيا | 5,000 | 5,500 |
| الكونغو-كينشاسا ('08) | 15,000 | 0 |
| الشركة | 2006 | 2007 | %المقابل |
|---|---|---|---|
| يونان تين (الصن) | 52,339 | 61,129 | 16.7 |
| پ.ت. تيماه (إندونسيا) | 44,689 | 58,325 | 30.5 |
| مينسور (پيرو) | 40,977 | 35,940 | -12.3 |
| مالاي (الصين) | 52,339 | 61,129 | 16.7 |
| Malaysia Smelting Corp (ماليزيا) | 22,850 | 25,471 | 11.5 |
مرض القصدير
 مقالة مفصلة: طاعون القصدير
مقالة مفصلة: طاعون القصدير
مرض القصدير أو طاعون القصدير مصطلح يشار به إلى تحول القصدير إلى مسحوق غبار عند إنخفاض درجة حرارته إلى ما دون 13.2 مئوية. وعلى مدى التاريخ، تحولت كميات من القصدير إلى مسحوق وصارت بذلك غير مفيدة، كما حصل مع أزرار ملابس جيش نابليون لدى إجتياحها لروسيا في فصل الشتاء. كما تعزى وفاة المستكشفين الأوائل للقطب الجنوبي لحواف علب الكيروسين التي تحولت إلى مسحوق في البرد وبالتالي لم يجد المستكشفون وقودا للتدفئة وماتوا بردا في عواصف ثلجية.
انظر أيضاً
- المجلس الدولي للقصدير
- Stannary
- تعليب
- Cassiterides (the mythical Tin Islands)
- Tin pest
- Whisker (metallurgy) (tin whiskers)
- Terne
- تعدين القصدير في بريطانيا
الهامش
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ هيام بيراقدار. "القصدير". الموسوعة العربية. Retrieved 2012-03-28.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةI230527 - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةUSGSCS2008 - ^ ITRI. الاتجاهات طويلة الأجل في تركيز الانتاج 1970–2006.
- ^ انتاج المعادن العالمي؛ 2002–06. المسح الجيولوجي البريطاني. Pg. 89. http://www.bgs.ac.uk/mineralsuk/downloads/wmp_2002_2006.pdf
- ^ "International Tin Research Institute. Top Ten Tin Producing Companies". Retrieved 2009-05-05.
وصلات خارجية
- WebElements.com – Tin
- Theodore Gray's Wooden Periodic Table Table: Tin samples and castings
- Base Metals: Tin
- Comprehensive Data on Tin
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||