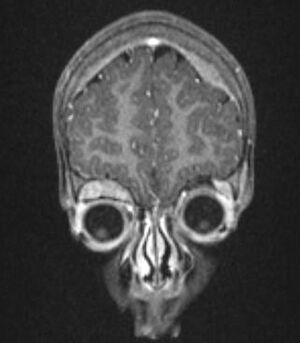
ورم الخلايا البدائية العصبية
| Neuroblastoma | |
|---|---|
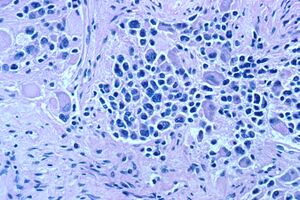
 | |
| Microscopic view of a typical neuroblastoma with rosette formation | |
| التخصص | Neuro-oncology |
| الأعراض | Bone pain, lumps[1] |
| البداية المعتادة | Under 5 years old[1] |
| المسببات | Genetic mutation[1] |
| الطريقة التشخيصية | Tissue biopsy[1] |
| العلاج | Observation, surgery, radiation, chemotherapy, stem cell transplantation[1] |
| Prognosis | US five-year survival ~95% (< 1 year old), 68% (1–14 years old)[2] |
| التردد | 1 in 7,000 children[2] |
| الوفيات | 15% of deaths due to cancer in children[3] |
ورم الخلايا البدائية العصبية ( NB ) هو نوع من السرطان يتشكل في أنواع معينة من الأنسجة العصبية.[1] غالبًا ما يبدأ من إحدى الغدد الكظرية ولكن يمكن أن يتطور أيضًا في الرقبة أو الصدر أو البطن أو العمود الفقري ..[1] قد تشمل الأعراض ألمًا في العظام أو تورمًا في البطن أو الرقبة أو الصدر أو كتلة مزرقة غير مؤلمة تحت الجلد..[1]
عادةً ما يحدث ورم الخلايا البدائية العصبية بسبب طفرة جينية تحدث أثناء التطور المبكر ..[4] نادرًا ما يكون ناتجًا عن طفرة موروثة من والدي الشخص .[1] لم يتم العثور على العوامل البيئية للمشاركة.[2] يعتمد التشخيص على خزعة الأنسجة.[1] في بعض الأحيان ، يمكن العثور عليه في الطفل عن طريق الموجات فوق الصوتية أثناء الحمل.[1] عند التشخيص ، يكون السرطان قد انتشر بالفعل.[1] ينقسم السرطان إلى مجموعات منخفضة ومتوسطة وعالية الخطورة بناءً على عمر الطفل ومرحلة السرطان وشكل السرطان.[1]
يعتمد العلاج والنتائج على مجموعة الخطر التي ينتمي إليها الشخص.[1][4] قد تشمل العلاجات الملاحظة أو الجراحة أو الإشعاع أو العلاج الكيميائي أو زرع الخلايا الجذعية.[1] عادةً ما يكون للأمراض منخفضة الخطورة عند الأطفال نتائج جيدة من خلال الجراحة أو مجرد الملاحظة.[4] ومع ذلك ، تقل فرص البقاء على قيد الحياة على المدى الطويل في الأمراض عالية الخطورة عن 40٪ ، على الرغم من العلاج المكثف.[4]
ورم الخلايا البدائية العصبية هو أكثر أنواع السرطانات شيوعًا عند الأطفال وثالث أكثر أنواع السرطانات شيوعًا عند الأطفال بعد ابيضاض الدم وسرطان الدماغ.[4] يتأثر حوالي واحد من كل 7000 طفل في وقت ما.[2] حوالي 90٪ من الحالات تحدث عند الأطفال أقل من 5 سنوات ، وهي نادرة عند البالغين.[2][3] حوالي 15٪ من وفيات السرطان لدى الأطفال بسبب ورم الخلايا البدائية العصبية.[3] تم وصف المرض لأول مرة في القرن التاسع عشر .[5]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العلامات والاعراض
غالبًا ما تكون الأعراض الأولى لورم الخلايا البدائية العصبية غامضة ، مما يجعل التشخيص صعبًا. يشيع التعب وفقدان الشهية والحمى وآلام المفاصل. تعتمد الأعراض على مواقع الورم الأولية والنقائل إذا كانت موجودة:[6]
- في البطن ، قد يسبب الورم انتفاخ البطن و الإمساك .
- قد يسبب ورم في الصدر مشاكل في التنفس .
- الورم الذي يضغط على النخاع الشوكي قد يسبب الضعف ، وبالتالي عدم القدرة على الوقوف أو الزحف أو المشي.
- قد تسبب آفات العظام في الساقين والوركين الألم والعرج.
- قد يتسبب وجود ورم في العظام حول العين أو الحجاج في حدوث كدمات وتورم واضحين.
- قد يسبب ارتشاح النخاع العظمي شحوبًا من فقر الدم .
غالبًا ما ينتشر ورم الخلايا البدائية العصبية إلى أجزاء أخرى من الجسم قبل ظهور أي أعراض ، و 50 إلى 60 ٪ من جميع حالات الورم الخلايا البدائية العصبية تظهر مع النقائل.[7]
المكان الأكثر شيوعًا لنشوء ورم الخلايا البدائية العصبية (أي الورم الأساسي) هو الغدد الكظرية. يحدث هذا في 40٪ من الأورام الموضعية وفي 60٪ من حالات انتشار المرض. يمكن أن يتطور ورم الخلايا البدائية العصبية أيضًا في أي مكان على طول سلسلة الجهاز العصبي الودي من الرقبة إلى الحوض. يشمل التكرار في أماكن مختلفة: الرقبة (1٪) ، الصدر (19٪) ، البطن (30٪ غير كظرية) ، أو الحوض (1٪). في حالات نادرة ، لا يمكن تمييز الورم الأولي.[8]
تشمل العروض التقديمية النادرة ولكن المميزة اعتلال النخاع المستعرض (انضغاط الحبل الشوكي بسبب الورم ، 5٪ من الحالات) ، الإسهال المقاوم للعلاج ( إفراز الببتيد المعوي الفعال وعائياً ، 4٪ من الحالات) ، متلازمة هورنر (ورم عنق الرحم ، 2.4٪ من الحالات) ، متلازمة رمع العين العضلي[9] والرنح (سبب مشتبه به للأباعد الورمية ، 1.3٪ من الحالات) ، وفرط ضغط الدم ( إفراز الكاتيكولامين أو ضغط الشريان الكلوي ، 1.3٪ من الحالات).[10]
السبب
سبب ورم الخلايا البدائية العصبية غير مفهوم جيدًا. الغالبية العظمى من الحالات منتشرة وغير ألوفة. حوالي 1-2٪ من الحالات تتوارث في العائلات وتم ربطها بطفرات جينية معينة. يحدث ورم الخلايا البدائية العصبية العائلي في بعض الحالات بسبب طفرات نادرة في السلالة الجرثومية في جين لمفومة الكيناز الكشمية ( ALK )..[11] وقد تورطت طفرات الإنتاشية في الجين PHOX2B أو KIF1B في ورم الخلايا البدائية العصبية أيضًا. ورم الخلايا البدائية العصبية هو أيضًا سمة من سمات الورم العصبي الليفي من النوع الأول ومتلازمة بيكويث-فيدمان.
تضخيم الجين الورمي MYCN داخل الورم هو اكتشاف شائع في ورم الخلايا البدائية العصبية. تُظهر درجة التضخيم توزيعًا ثنائي النسق: إما من 3 إلى 10 أضعاف ، أو من 100 إلى 300 ضعف. يرتبط وجود هذه الطفرة ارتباطًا وثيقًا بالمراحل المتقدمة من المرض..[12]
ثبت أن المقاطع المضاعفة من جين LMO1 داخل الخلايا السرطانية لورم الخلايا البدائية العصبية تزيد من خطر الإصابة بنوع عدواني من السرطان.[13]
تم ربط ورم الخلايا البدائية العصبية باختلاف رقم النسخ داخل جين NBPF10 ، مما يؤدي إلى متلازمة حذف 1q21.1 أو متلازمة الازدواج 1q21.1.[14]
تم اقتراح العديد من عوامل الخطر وهي موضوع البحث المستمر. نظرا لبداية مبكرة مميزة، وقد ركزت العديد من الدراسات حول العوامل الأبوية حول الحمل وأثناء الولادة . تضمنت العوامل التي تم فحصها المهنة (أي التعرض للمواد الكيميائية في صناعات معينة) ، والتدخين ، واستهلاك الكحول ، واستخدام العقاقير الطبية أثناء الحمل ، وعوامل الولادة ؛ ومع ذلك ، كانت النتائج غير حاسمة.[15]
درست دراسات أخرى الروابط المحتملة مع التأتب والتعرض للعدوى في وقت مبكر من الحياة ،,[16] استخدام الهرمونات وأدوية الخصوبة,[17] واستخدام الأم لصبغة الشعر.[18][19]
التشخيص
عادة ما يتم تأكيد التشخيص من قبل أخصائي علم الأمراض الجراحي ، مع مراعاة العرض السريري والنتائج المجهرية والاختبارات المعملية الأخرى. قد ينشأ من أي عنصر عرف عصبي في الجهاز العصبي السمبثاوي (SNS).
يُعتقد أن ورم الخلايا البدائية العصبية الحسي ، المعروف أيضًا باسم ورم الخلايا البدائية العصبية الشمي ، ينشأ من الظهارة الشمية ولا يزال تصنيفها مثيرًا للجدل. ومع ذلك ، نظرًا لأنه ليس ورمًا خبيثًا في الجهاز العصبي الودي ، فإن ورم الخلايا البدائية العصبية الحسي هو كيان سريري متميز ولا يجب الخلط بينه وبين ورم الخلايا البدائية العصبية.[20][21]
الكيمياء الحيوية
في حوالي 90٪ من حالات ورم الخلايا البدائية العصبية، توجد مستويات مرتفعة من الكاتيكولامينات أو مستقلباتها في البول أو الدم. تشمل الكاتيكولامينات ومستقلباتها الدوبامين وحمض الهوموفانيليك (HVA) و / أو حمض الڤانليل ماندليك (VMA).[22]
التصوير الطبي
هناك طريقة أخرى للكشف عن ورم الخلايا البدائية العصبية وهي فحص ميتا يودوبنزيل جوانيدين، والتي يتم التقاطها بنسبة 90 إلى 95٪ من جميع اورام الخلايا البدائية العصبية ، والتي يطلق عليها غالبًا "mIBG-avid".[23] الآلية هي أن mIBG يتم التقاطه بواسطة الخلايا العصبية الودية ، وهو نظير وظيفي للناقل العصبي نورإپينفرين. عندما يتم معالجته باليود المشع بـ I-131 أو I-123 ( نظائر اليود المشعة) ، فهو دواء إشعاعي جيد جدًا لتشخيص ومراقبة الاستجابة للعلاج لهذا المرض. مع عمر نصف يبلغ 13 ساعة ، فإن I-123 هو النظير المفضل لحساسية التصوير وجودته. يمتاز I-131 بعمر نصف يبلغ 8 أيام وعند الجرعات العالية يعتبر علاجًا فعالًا مثل الإشعاع الموجه ضد الورم الخلايا البدائية العصبية الانتكاسي والحرون.[24] نظرًا لأن اورام الخلايا البدائية العصبية لا تلتقط mIBG دائمًا ، فقد اكتشف الباحثون في الأطفال المصابين بورم الخلايا البدائية العصبية ما إذا كان هناك نوع آخر من التصوير النووي ، وهو التصوير المقطعي بالإصدار البوزيتروني الفلوري-ديوكسي الجلوكوز ، والذي يُطلق عليه غالبًا اسم "F-FDG-PET"..[25] تشير الدلائل إلى أنه قد يكون من المستحسن استخدام هذا في الأطفال المصابين بورم الخلايا البدائية العصبية الذي لا يعمل فيه mIBG ، ولكن هناك حاجة إلى مزيد من البحث في هذا المجال.[25]
علم الانسجة
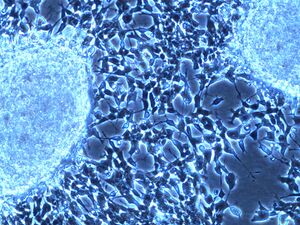
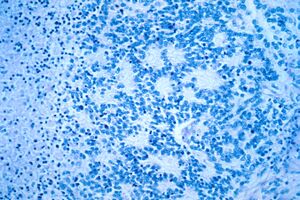
في الفحص المجهري ، توصف خلايا الورم عادةً بأنها صغيرة ، مستديرة وأزرق ، ويمكن رؤية أنماط وردية ( هومر رايت الوردية الزائفة) . ( هومر رايت الوردية الزائفة) هي خلايا سرطانية حول اللبد العصبي ، لا ينبغي الخلط بينها وبين الوريدات الحقيقية ، وهي خلايا ورمية حول تجويف فارغ.[26] كما أنها تختلف عن الأشكال الوردية الكاذبة للورم البطاني العصبي الذي يتكون من الخلايا السرطانية مع البروتين الحمضي الليفي الدبقي (GFAP) - عمليات إيجابية تتناقص نحو الأوعية الدموية (وبالتالي مزيج من الاثنين)..[27] يستخدم اختصاصيو علم الأمراض مجموعة متنوعة من الصبغات الكيميائية النسيجية المناعية لتمييز اورام الخلايا البدائية العصبية عن المقلدات النسيجية ، مثل الساركوما العضلية المخططة ، وساركوما إوينغ ، ولمفوما ، وورم ويلمز .[28]
ورم الخلايا البدائية العصبية هو أحد الأورام الأرومية العصبية المحيطية (pNTs) التي لها أصول متشابهة وتظهر نمطًا واسعًا من التمايز بدءًا من الورم العصبي العقدي الحميد إلى الورم العصبي العقدي الغني بالسدى مع الخلايا الأرومية العصبية المختلطة أو في العقيدات ، إلى ورم الخلايا البدائية العصبية الخبيث للغاية. هذا التمييز في علم أمراض الأورام قبل العلاج هو عامل مهم في المآل ، إلى جانب العمر ومؤشر الانقسام الفتيلي- تمزق النواة (MKI). يصف نظام تصنيف علم الأمراض (نظام شيمادا) الأورام "المواتية" و "غير المواتية" من قبل اللجنة الدولية لأمراض ورم الخلايا البدائية العصبية (INPC) التي تأسست في عام 1999 ورُجعت في عام 2003..[29]
تصنيف المراحل
تم إنشاء "نظام التدريج الدولي لورم الخلايا البدائية العصبية" (INSS) في عام 1986 وتم تعديله في عام 1988 وفقًا لوجوده التشريحي عند التشخيص:[30][31][32]
- المرحلة 1: ورم موضعي محدود في منطقة المنشأ.
- المرحلة 2 أ: ورم أحادي الجانب مع استئصال إجمالي غير كامل ؛ يمكن تحديد العقدة الليمفاوية المماثل والمقابلة سلبية الورم.
- المرحلة 2 ب: ورم أحادي الجانب مع استئصال كامل أو غير كامل ؛ مع العقدة الليمفاوية المماثلة إيجابية للورم ؛ العقدة الليمفاوية المقابلة التي يمكن تحديدها سلبية للورم.
- المرحلة 3: انتشار الورم عبر خط المتوسط مع أو بدون تورط العقدة الليمفاوية الإقليمية ؛ أو ورم من جانب واحد مع إصابة العقدة الليمفاوية المقابلة ؛ أو ورم خط المتوسط مع إصابة العقدة الليمفاوية الثنائية.
- المرحلة 4: انتشار الورم إلى الغدد الليمفاوية البعيدة أو نخاع العظام أو العظام أو الكبد أو الأعضاء الأخرى باستثناء ما هو محدد في المرحلة 4S.
- المرحلة 4S: العمر أقل من سنة مع وجود ورم أولي موضعي كما هو محدد في المرحلة 1 أو 2 ، مع انتشار محدود للكبد أو الجلد أو نخاع العظام (أقل من 10 في المائة من خلايا نخاع العظم المنواة هي أورام).
على الرغم من استخدام الاتفاق الدولي على التدريج (INSS) ، فقد تم الاعتراف أيضًا بالحاجة إلى إجماع دولي حول تحديد المخاطر من أجل مقارنة مجموعات مماثلة في نتائج الدراسات. ابتداءً من عام 2005 ، اجتمع ممثلو المجموعات التعاونية الرئيسية لطب أورام الأطفال لمراجعة البيانات الخاصة بـ 8800 شخص مصاب بورم الخلايا البدائية العصبية الذين عولجوا في أوروبا واليابان والولايات المتحدة الأمريكية وكندا وأستراليا بين عامي 1990 و 2002. اقترحت فرقة العمل هذه نظام تصنيف المجموعة الدولية لمخاطر ورم الخلايا البدائية العصبية (INRG). كشفت الدراسات بأثر رجعي عن ارتفاع معدل البقاء على قيد الحياة للفئة العمرية من 12 إلى 18 شهرًا ، والتي تم تصنيفها سابقًا على أنها عالية المخاطر ، ودفعت إلى اتخاذ قرار إعادة تصنيف الأطفال الذين تتراوح أعمارهم بين 12 و 18 شهرًا دون تضخيم N- myc (يشار إليه أيضًا باسم MYCN ) إلى فئة المخاطر المتوسطة.[33]
ستقوم مهمة المجموعة الدولية لمخاطر ورم الخلايا البدائية العصبية الجديدة بتصنيف ورم الخلايا البدائية العصبية عند التشخيص بناءً على نظام تصنيف دولي جديد لمجموعة مخاطر ورم الخلايا البدائية العصبية(INRGSS):
- المرحلة L1: مرض موضعي بدون عوامل خطر محددة بالاشعة.
- المرحلة L2: مرض موضعي مع عوامل خطر محددة بالاشعة
- المرحلة M: المرض النقيلي.
- المرحلة MS: المرض النقيلي "الخاص" حيث يكون مرض التصلب العصبي المتعدد معادلاً للمرحلة 4S.
سيعتمد التصنيف الطبقي الجديد للمخاطر على نظام التدريج INRGSS الجديد ، والعمر (مقسم إلى 18 شهرًا) ، ودرجة الورم ، وتضخيم N-myc ، والانحراف غير المتوازن 11q ، و الصيغة الصبغية إلى أربع مجموعات مخاطر ما قبل العلاج: مخاطر منخفضة جدًا ومنخفضة ومتوسطة ،و عالية.[4][34]
الفحص
يمكن أن يرتفع مستوى الكاتيكولامين في البول في ورم الخلايا البدائية العصبية قبل السريرية. تم إجراء فحص للرضع بدون أعراض في عمر ثلاثة أسابيع وستة أشهر وسنة واحدة في اليابان وكندا والنمسا وألمانيا منذ الثمانينيات.[35][36] بدأت اليابان في فحص الأطفال البالغين من العمر ستة أشهر بحثًا عن ورم الخلايا البدائية العصبية عن طريق تحليل مستويات حمض الهوموفانيليك وحمض الفانيلمانديليك في عام 1984. توقف الفحص في عام 2004 بعد أن أظهرت دراسات في كندا وألمانيا عدم حدوث انخفاض في الوفيات بسبب ورم الخلايا البدائية العصبية ، بل تسببت في زيادة التشخيصات التي كانت ستختفي دون علاج ، مما يعرض هؤلاء الأطفال لعملية جراحية وعلاج كيماوي غير ضروريين[37][38][39]
العلاج
عندما تكون الآفة موضعية ، فهي قابلة للشفاء بشكل عام. ومع ذلك ، فإن البقاء على قيد الحياة على المدى الطويل للأطفال الذين يعانون من مرض متقدم أكبر من 18 شهرًا من العمر ضعيف على الرغم من العلاج متعدد الدوارج ( العلاج الكيميائي المكثف والجراحة والعلاج الإشعاعي وزرع الخلايا الجذعية وعامل التمايز أيزوتريتينوين ويسمى أيضًا حمض 13- سيس- ريتينويك ، وفي كثير من الأحيان العلاج المناعي[40] مع العلاج بالأجسام المضادة أحادية النسيلة المضادة لـ GD2 - دينوتوكسيماب )).
تم تحديد الخصائص البيولوجية والوراثية ، والتي ، عند إضافتها إلى التدريج السريري الكلاسيكي ، سمحت بتحديد لمجموعات الخطر لتخطيط كثافة العلاج.[41] تشمل هذه المعايير عمر الشخص ، ومدى انتشار المرض ، والمظهر المجهري ، والخصائص الجينية بما في ذلك الحمض النووي الصبغي وتضخيم الجين الورمي N-myc (ينظم N-myc الرنا الميكروي[42]إلى مرض منخفض ومتوسط وعالي الخطورة. قامت دراسة بيولوجية حديثة (COG ANBL00B1) بتحليل 2687 شخصًا مصابًا بورم الخلايا البدائية العصبية وتم تحديد نطاق تعيين المخاطر: 37٪ من حالات ورم الخلايا البدائية العصبية منخفضة الخطورة ، 18٪ متوسطة الخطورة ، 45٪ عالية الخطورة.[43] هناك بعض الأدلة على أن الأنواع عالية ومنخفضة المخاطر ناتجة عن آليات مختلفة ، وليست مجرد درجتين مختلفتين من التعبير عن نفس الآلية..)[44]
تختلف العلاجات الخاصة بفئات المخاطر المختلفة هذه اختلافًا كبيرًا.
- يمكن ملاحظة المرض منخفض الخطورة في كثير من الأحيان دون أي علاج على الإطلاق أو علاجه بالجراحة وحدها.[45]
- يتم علاج الأمراض ذات الخطورة المتوسطة بالجراحة والعلاج الكيميائي.[46]
- يتم علاج ورم الخلايا البدائية العصبية عالي الخطورة من خلال العلاج الكيميائي المكثف والجراحة والعلاج الإشعاعي وزرع الخلايا الجذعية المكونة للدم /نخاع العظام,[47] والعلاج البيولوجي باستخدام 13- المقرون - حمض الريتنويك ( آيزوتريتينوين أو اكوتاني)[48] والعلاج بالأجسام المضادة عادةً ما يتم إعطاؤه مع سيتوكينات عامل منبه لمستعمرات المحببات والبلاعم و إنترلوكين-2.[49] وجد التحليل التلوي دليلاً على أنه في الأطفال الذين يعانون من ورم الخلايا البدائية العصبية عالي الخطورة ، فإن العلاج باستخدام العلاج المزيل للنقي يحسن البقاء على قيد الحياة بدون أحداث ولكنه قد يزيد من خطر الآثار الجانبية مثل مشاكل الكلى عند مقارنته بالعلاج الكيميائي التقليدي.[50]
الأشخاص المصابون بمرض منخفض ومتوسط الخطورة لديهم تشخيص ممتاز بمعدلات شفاء أعلى من 90٪ للمخاطر المنخفضة و 70-90٪ للمخاطر المتوسطة. في المقابل ، علاج ورم الخلايا البدائية العصبية عالي الخطورة في العقدين الماضيين[when?] .[51] أدت إضافة العلاج بالأجسام المضادة إلى زيادة معدلات البقاء على قيد الحياة للأمراض عالية الخطورة بشكل ملحوظ. في مارس 2009 ، أظهر تحليل مبكر لمجموعة أورام الأطفال (COG) مع 226 شخصًا معرضين لمخاطر عالية أنه بعد عامين من زرع الخلايا الجذعية ، تم اختيار 66 ٪ من المجموعة بشكل عشوائي لتلقي الجسم المضاد ch14.18 مع GM-CSF و إنترلوكين -2 كانوا أحياء وخالون من الأمراض مقارنة بـ 46٪ فقط في المجموعة التي لم تتلق الجسم المضاد. تم إيقاف التعشية بحيث يتلقى جميع الأشخاص المسجلين في التجربة العلاج بالأجسام المضادة..[52]
تم العثور على عوامل العلاج الكيميائي المستخدمة مجتمعة لتكون فعالة ضد ورم الخلايا البدائية العصبية. العوامل التي يشيع استخدامها في الحث وحالات زرع الخلايا الجذعية هي مركبات بلاتينيى ( سيسبلاتين ، كاربوبلاتين )، عوامل مؤلكلة سيكلوفوسفاميد ، إيفوسفامايد ، ملفلان )، مثبط توبوإيزوميراز II ( إيتوبوسيد )، أنثراسيكلين المضادات الحيوية ( دوكسوروبيسين ) و اشباه قلوانيات الفينكا ( فينكريستين ). تتضمن بعض الأنظمة الحديثة مثبطات توبويزوميراز 1 ( توبوتيكان وإرينوتيكان ) في الحث والتي ثبت أنها فعالة ضد المرض المتكرر.
في نوفمبر 2020 ، تمت الموافقة على ناكسيتاماب للاستخدام الطبي في الولايات المتحدة بالاشتراك مع عامل تحفيز مستعمرة خلايا البلاعم المحببة (GM-CSF) لعلاج الأشخاص الذين يبلغون من العمر عامًا أو أكبر والذين يعانون من ورم الخلايا البدائية العصبية شديد الخطورة في العظام أو نخاع العظام والذين لم يستجب الورم لديهم أو عاد بعد العلاجات السابقة وأظهر استجابة جزئية أو استجابة طفيفة أو مرض مستقر للعلاج السابق..[53][54]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المآل
وفقًا لبيانات من إنجلترا ، فإن معدل البقاء على قيد الحياة لمدة 5 سنوات من ورم الخلايا البدائية العصبية هو 67٪.[55] ما بين 20٪ و 50٪ من الحالات عالية الخطورة لا تستجيب بشكل كافٍ لحث جرعة عالية من العلاج الكيميائي وهي تقدمية أو مقاومة للعلاج.[56][57] يعد الانتكاس بعد الانتهاء من علاج الخط الأمامي أمرًا شائعًا أيضًا. يتوفر المزيد من العلاج في المرحلة الأولى والمرحلة الثانية من التجارب السريرية التي تختبر عوامل جديدة ومجموعات من العوامل ضد ورم الخلايا البدائية العصبية ، ولكن النتيجة تبقى سيئة للغاية بالنسبة لمرض منتكس عالي الخطور.[58]
كان معظم الناجين على المدى الطويل الذين علي قيد الحياة الان اليوم يعانون من مرض منخفض أو متوسط الخطورة ودورات علاج أكثر اعتدالًا مقارنة بالأمراض عالية الخطورة. غالبية الناجين لديهم آثار طويلة المدى من العلاج. غالبًا ما يعاني الناجون من العلاج المتوسط وعالي الخطورة من فقدان السمع ، وتقليل النمو ، واضطرابات وظائف الغدة الدرقية ، وصعوبات التعلم ، وزيادة مخاطر الإصابة بالسرطان الثانوي التي تؤثر على الناجين من الأمراض عالية الخطورة..[59][60] ما يقدر بنحو اثنين من ثلاثة ناجين من سرطان الأطفال سيصابون في النهاية بمشكلة صحية مزمنة واحدة على الأقل وأحيانًا تهدد الحياة في غضون 20 إلى 30 عامًا بعد تشخيص السرطان.[61][62][63]
مظاهر جينية خلوية
استنادًا إلى سلسلة من 493 عينة من ورم الخلايا البدائية العصبية ، تم الإبلاغ عن أن النمط الجيني العام ، كما تم اختباره بواسطة التنميط النووي القائم على المصفوفة ، هو مؤشر على النتائج في ورم الخلايا البدائية العصبية:[64]
- كانت الأورام التي تظهر حصريًا مع تغيرات كاملة في عدد نسخ الكروموسوم مرتبطة ببقاء ممتاز.
- ارتبطت الأورام التي تظهر مع أي نوع من التغييرات في عدد نسخ الكروموسوم الجزئي بارتفاع مخاطر الانتكاس.
- ضمن الأورام التي تظهر تغيرات جزئية، كانت المؤشرات المستقلة الإضافية لانخفاض معدل البقاء الكلي هي تضخيم N-myc ، وحذف 1p و 11q ، وكسب 1q.
صنفت المنشورات السابقة الاورام الخلايا البدائية العصبية إلى ثلاثة أنواع فرعية رئيسية بناءً على الملامح الوراثية الخلوية::[65][66]
- النوع الفرعي 1: ورم الخلايا البدائية العصبية مواتٍ مع ثلاثي الصبغيات تقريبًا وهيمنة المكاسب والخسائر العددية ، والتي تمثل في الغالب مراحل NB غير النقيلية 1 و 2 و 4 S.
- النوعان الفرعيان 2A و 2B: موجودان في ورم الخلايا البدائية العصبية غير المواتي على نطاق واسع ، المرحلتان 3 و 4 ، مع فقدان 11q وكسب 17q بدون تضخيم N-myc (النوع الفرعي 2A) أو مع تضخيم N-myc غالبًا مع حذف 1p وكسب 17q (النوع الفرعي 2B).
يمكن إجراء التنميط النووي الافتراضي على الأورام الجديدة أو التي تحتوي على البارافين لتقييم عدد النسخ في هذه المواقع. يُفضل التنميط النووي الافتراضي لمجموعة النوكليوتيدات المفردة لعينات الورم ، بما في ذلك اورام الخلايا البدائية العصبية ، لأنها يمكن أن تكتشف الفقد المحايد للنسخة متغايرة الزيجوت (خلل أحادي الوالدين المكتسب). يمكن أن تكون نسخة LOH المحايدة مكافئة بيولوجيًا للحذف وقد تم اكتشافها في مواضع رئيسية في ورم الخلايا البدائية العصبية..[67] لا تستطيع مصفوفة التهجين الجيني المقارن أو مضان في الموقع التهجي أو علم الوراثة الخلوية التقليدية اكتشاف نسخة LOH المحايدة.
علم الاوبئة
يشكّل ورم الخلايا البدائية العصبية 6-10٪ من جميع سرطانات الأطفال ، و 15٪ من وفيات السرطان لدى الأطفال. معدل الوفيات السنوي هو 10 لكل مليون طفل في الفئة العمرية من 0 إلى 4 سنوات ، و 4 لكل مليون في الفئة العمرية من 4 إلى 9 سنوات.[69]
أكبر عدد من الحالات يكون في السنة الأولى من العمر ، وبعض الحالات خلقية . النطاق العمري واسع ، بما في ذلك الأطفال الأكبر سنًا والبالغين,[70] ولكن 10٪ فقط من الحالات تحدث في الأشخاص الذين تزيد أعمارهم عن 5 سنوات.[23] أفادت دراسة أوروبية كبيرة أن أقل من 2٪ من أكثر من 4000 حالة ورم الخلايا البدائية العصبية تزيد أعمارهم عن 18 عامًا.[71]
التاريخ

في عام 1864 ، كان الطبيب الألماني رودولف فيرشو أول من وصف ورمًا في البطن عند الطفل بأنه "ورم دبقي". تمت ملاحظة خصائص الأورام من الجهاز العصبي الودي ولب الكظر في عام 1891 من قبل عالم الأمراض الألماني فيليكس مارشان.[72][73] في عام 1901 ، وصف ويليام بيبر العرض المميز للمرحلة 4S عند الرضع (الكبد ولكن بدون نقائل عظمي). في عام 1910 ، أدرك جيمس هومر رايت أن الورم ينشأ من الخلايا العصبية البدائية ، وأطلق عليه اسم ورم الخلايا البدائية العصبية. كما لاحظ الكتل الدائرية للخلايا في عينات نخاع العظم والتي تسمى الآن "ورديات هومر رايت". وتجدر الإشارة إلى أن كلمة "Homer-Wright" التي تحتوي على واصلة غير صحيحة نحويًا ، حيث يشير الاسم نفسه إلى الدكتور رايت فقط.[74]
المجتمع والبيئة
الجهود التشريعية
نجح النائب الأمريكي شيت إدواردز من مدينة واكو بولاية تكساس في تقديم تشريع لتخصيص 150 مليون دولار لعلاج ورم الخلايا البدائية العصبية وأنواع السرطان الأخرى. تم التوقيع على هذا الإجراء ليصبح قانونًا في يوليو 2008 من قبل الرئيس الأمريكي جورج دبليو بوش . استوحى إدواردز في هذا المسعى من مرض إيرين تشانينج بوينجر (1997-2009) ووفاة بريان ، ابنة أحد ناخبيه ، والتر إل بوينجر ، رئيس قسم التاريخ في جامعة تكساس إيه آند إم.[75]
البحث العلمي
النماذج قبل السريرية
تم إنشاء طعم أجنبي مشتق من الورم (PDXs) لمريض ورم الخلايا البدائية العصبية عن طريق زرع عينات من الورم في الفئران التي تعاني من نقص المناعة.[76] تتمتع نماذج PDX بالعديد من المزايا مقارنة بخطوط الخلايا السرطانية التقليدية (CCL)..[77] يحتفظ ورم الخلايا البدائية العصبية PDXs بالسمات الجينية للأورام المقابلة لها ، بينما تعرض PDXs نموًا تسلسليًا ونقائل للأعضاء البعيدة.[76] تعد نماذج PDX أكثر تنبؤًا بالنتائج السريرية مقارنةً بطعوم الاجنبية لخط الخلايا السرطانية التقليدية.[78] وبالتالي قد تعمل PDXs لورم الخلايا البدائية العصبية كنماذج ذات صلة سريريًا لتحديد المركبات الفعالة ضد ورم الخلايا البدائية العصبية..[76]
العلاجات
كان التركيز مؤخرًا على الحد من علاج ورم الخلايا البدائية العصبية منخفض الخطورة ومتوسط الخطورة مع الحفاظ على معدلات البقاء على قيد الحياة عند 90٪.[79] أكدت دراسة أجريت على 467 شخصًا في خطر متوسط والمسجلين في A3961 من 1997 إلى 2005 الفرضية القائلة بأن العلاج يمكن تقليله بنجاح لهذه المجموعة المعرضة للخطر. تلقى أولئك الذين يتمتعون بخصائص مواتية (درجة الورم والاستجابة) أربع دورات من العلاج الكيميائي ، وتلقى أولئك الذين لديهم خصائص غير مواتية ثماني دورات ، مع بقاء لمدة ثلاث سنوات بدون أحداث واستقرار إجمالي للبقاء عند 90 ٪ للمجموعة بأكمله. الخطط المستقبلية هي تكثيف العلاج لأولئك الأشخاص الذين يعانون من انحراف الكروموسومات 1p36 أو 11q23 وكذلك لأولئك الذين يفتقرون إلى الاستجابة المبكرة للعلاج.[80][81]
على النقيض من ذلك ، كان التركيز على مدار العشرين عامًا الماضية أو أكثر هو تكثيف علاج ورم الخلايا البدائية العصبية عالي الخطورة. لا يزال يتم فحص اختلافات حث العلاج الكيميائي ، وتوقيت الجراحة ، وأنظمة زرع الخلايا الجذعية ، وخطط التسليم المختلفة للإشعاع ، واستخدام الأجسام المضادة وحيدة النسيلة والريتينويدات لعلاج الحد الأدنى من الأمراض المتبقية. تم إجراء تجارب سريرية حديثة للمرحلة الثالثة مع التعشية للإجابة على هذه الأسئلة لتحسين بقاء الأمراض عالية الخطورة:
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Refractory and relapsed neuroblastoma
كثيرا ما يستخدم العلاج الكيميائي مع توبوتيكان وسيكلوفوسفاميد في ظروف مقاومة للحرارة وبعد الانتكاس.[82]
تتم دراسة زراعة الخلايا الجذعية أحادية التطابق ، أي خلايا المتبرع المشتقة من الوالدين ، في أولئك الذين يعانون من ورم الخلايا البدائية العصبية المقاوم أو الانتكاس لأن الخلايا الجذعية من الشخص نفسه ليست مفيدة.[83]
المراجع
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض "Neuroblastoma Treatment". National Cancer Institute. 20 January 2016. Archived from the original on 10 November 2016. Retrieved 9 November 2016.
- ^ أ ب ت ث ج "Neuroblastoma Treatment". National Cancer Institute. 25 August 2016. Archived from the original on 10 November 2016. Retrieved 10 November 2016.
- ^ أ ب ت World Cancer Report 2014. World Health Organization. 2014. Chapter 5.16. ISBN 978-9283204299. Archived from the original on 2016-09-19. Retrieved 2016-11-10.
- ^ أ ب ت ث ج ح Maris JM, Hogarty MD, Bagatell R, Cohn SL (June 2007). "Neuroblastoma". Lancet. 369 (9579): 2106–20. doi:10.1016/S0140-6736(07)60983-0. PMID 17586306. S2CID 208790138.
- ^ Olson, James Stuart (1989). The History of Cancer: An Annotated Bibliography (in الإنجليزية). ABC-CLIO. p. 177. ISBN 9780313258893. Archived from the original on 2017-09-10.
- ^ Wheeler, Kate (January 1, 2013). "Neuroblastoma in children". Macmillan. Archived from the original on October 5, 2015.
- ^ "Neuroblastoma: Pediatric Cancers: Merck Manual Professional". Archived from the original on 2007-12-18. Retrieved 2008-01-01.
- ^ Friedman GK, Castleberry RP (December 2007). "Changing trends of research and treatment in infant neuroblastoma". Pediatric Blood & Cancer. 49 (7 Suppl): 1060–5. doi:10.1002/pbc.21354. PMID 17943963. S2CID 37657305.
- ^ Rothenberg AB, Berdon WE, D'Angio GJ, Yamashiro DJ, Cowles RA (July 2009). "The association between neuroblastoma and opsoclonus-myoclonus syndrome: a historical review". Pediatric Radiology. 39 (7): 723–6. doi:10.1007/s00247-009-1282-x. PMID 19430769. S2CID 24523263.
- ^ Cheung, Nai-Kong (2005). Neuroblastoma. Springer-Verlag. pp. 66–7. ISBN 978-3-540-40841-3.
- ^ Mossé YP, Laudenslager M, Longo L, Cole KA, Wood A, Attiyeh EF, et al. (October 2008). "Identification of ALK as a major familial neuroblastoma predisposition gene". Nature. 455 (7215): 930–5. Bibcode:2008Natur.455..930M. doi:10.1038/nature07261. PMC 2672043. PMID 18724359.
- ^ Brodeur GM, Seeger RC, Schwab M, Varmus HE, Bishop JM (June 1984). "Amplification of N-myc in untreated human neuroblastomas correlates with advanced disease stage". Science. 224 (4653): 1121–4. Bibcode:1984Sci...224.1121B. doi:10.1126/science.6719137. PMID 6719137.
- ^ Wang K, Diskin SJ, Zhang H, Attiyeh EF, Winter C, Hou C, et al. (January 2011). "Integrative genomics identifies LMO1 as a neuroblastoma oncogene". Nature. 469 (7329): 216–20. Bibcode:2011Natur.469..216W. doi:10.1038/nature09609. PMC 3320515. PMID 21124317.
{{cite journal}}: Unknown parameter|lay-date=ignored (help); Unknown parameter|lay-source=ignored (help); Unknown parameter|lay-url=ignored (help) - ^ Diskin SJ, Hou C, Glessner JT, Attiyeh EF, Laudenslager M, Bosse K, et al. (June 2009). "Copy number variation at 1q21.1 associated with neuroblastoma". Nature. 459 (7249): 987–91. Bibcode:2009Natur.459..987D. doi:10.1038/nature08035. PMC 2755253. PMID 19536264.
- ^ Olshan AF, Bunin GR (2000). "Epidemiology of Neuroblastoma". In Brodeur GM, Sawada T, Tsuchida Y, et al. (eds.). Neuroblastoma. Amsterdam: Elsevier. pp. 33–9. ISBN 978-0-444-50222-3.
- ^ Menegaux F, Olshan AF, Neglia JP, Pollock BH, Bondy ML (May 2004). "Day care, childhood infections, and risk of neuroblastoma". American Journal of Epidemiology. 159 (9): 843–51. doi:10.1093/aje/kwh111. PMC 2080646. PMID 15105177.
- ^ Olshan AF, Smith J, Cook MN, Grufferman S, Pollock BH, Stram DO, et al. (November 1999). "Hormone and fertility drug use and the risk of neuroblastoma: a report from the Children's Cancer Group and the Pediatric Oncology Group". American Journal of Epidemiology. 150 (9): 930–8. doi:10.1093/oxfordjournals.aje.a010101. PMID 10547138.
- ^ McCall EE, Olshan AF, Daniels JL (August 2005). "Maternal hair dye use and risk of neuroblastoma in offspring". Cancer Causes & Control. 16 (6): 743–8. doi:10.1007/s10552-005-1229-y. PMID 16049813. S2CID 24323871.
- ^ Heck JE, Ritz B, Hung RJ, Hashibe M, Boffetta P (March 2009). "The epidemiology of neuroblastoma: a review". Paediatric and Perinatal Epidemiology. 23 (2): 125–43. doi:10.1111/j.1365-3016.2008.00983.x. PMID 19159399.
- ^ Esthesioneuroblastoma at eMedicine
- ^ Cheung, Nai-Kong (2005). Neuroblastoma. Springer-Verlag. p. 73. ISBN 978-3-540-40841-3.
- ^ Strenger V, Kerbl R, Dornbusch HJ, Ladenstein R, Ambros PF, Ambros IM, Urban C (May 2007). "Diagnostic and prognostic impact of urinary catecholamines in neuroblastoma patients". Pediatric Blood & Cancer. 48 (5): 504–9. doi:10.1002/pbc.20888. PMID 16732582. S2CID 34838939.
- ^ أ ب Howman-Giles R, Shaw PJ, Uren RF, Chung DK (July 2007). "Neuroblastoma and other neuroendocrine tumors". Seminars in Nuclear Medicine. 37 (4): 286–302. doi:10.1053/j.semnuclmed.2007.02.009. PMID 17544628.
- ^ Pashankar FD, O'Dorisio MS, Menda Y (January 2005). "MIBG and somatostatin receptor analogs in children: current concepts on diagnostic and therapeutic use". Journal of Nuclear Medicine. 46 Suppl 1 (Suppl 1): 55S–61S. PMID 15653652.
- ^ أ ب Bleeker G, Tytgat GA, Adam JA, Caron HN, Kremer LC, Hooft L, van Dalen EC (September 2015). "123I-MIBG scintigraphy and 18F-FDG-PET imaging for diagnosing neuroblastoma". The Cochrane Database of Systematic Reviews (9): CD009263. doi:10.1002/14651858.cd009263.pub2. PMC 4621955. PMID 26417712.
- ^ Robbins and Cotran pathologic basis of disease (9 ed.). Elsevier. 2015. ISBN 978-1455726134.
- ^ Ependymoma at eMedicine
- ^ Carter RL, al-Sams SZ, Corbett RP, Clinton S (May 1990). "A comparative study of immunohistochemical staining for neuron-specific enolase, protein gene product 9.5 and S-100 protein in neuroblastoma, Ewing's sarcoma and other round cell tumours in children". Histopathology. 16 (5): 461–7. doi:10.1111/j.1365-2559.1990.tb01545.x. PMID 2163356. S2CID 6461880.
- ^ Peuchmaur M, d'Amore ES, Joshi VV, Hata J, Roald B, Dehner LP, et al. (November 2003). "Revision of the International Neuroblastoma Pathology Classification: confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma, nodular". Cancer. 98 (10): 2274–81. doi:10.1002/cncr.11773. PMID 14601099. S2CID 27081822.
- ^ "Neuroblastoma Treatment—National Cancer Institute". 1980-01-01. Archived from the original on 2008-10-02. Retrieved 2008-07-30.
- ^ Brodeur GM, Seeger RC, Barrett A, Berthold F, Castleberry RP, D'Angio G, et al. (December 1988). "International criteria for diagnosis, staging, and response to treatment in patients with neuroblastoma" (PDF). Journal of Clinical Oncology. 6 (12): 1874–81. doi:10.1200/JCO.1988.6.12.1874. PMID 3199170.
- ^ Brodeur GM, Pritchard J, Berthold F, Carlsen NL, Castel V, Castelberry RP, et al. (August 1993). "Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment". Journal of Clinical Oncology. 11 (8): 1466–77. doi:10.1200/JCO.1993.11.8.1466. PMID 8336186.
- ^ Schmidt ML, Lal A, Seeger RC, Maris JM, Shimada H, O'Leary M, et al. (September 2005). "Favorable prognosis for patients 12 to 18 months of age with stage 4 nonamplified MYCN neuroblastoma: a Children's Cancer Group Study". Journal of Clinical Oncology. 23 (27): 6474–80. doi:10.1200/JCO.2005.05.183. PMID 16116154.
- ^ Cohn SL, London WB, Monclair T, Matthay KK, Ambros PF, Pearson AD (2007). "Update on the development of the international neuroblastoma risk group (INRG) classification schema". Journal of Clinical Oncology. 25 (18 Suppl): 9503. doi:10.1200/jco.2007.25.18_suppl.9503. Archived from the original on 2016-01-10.
- ^ Woods WG, Gao RN, Shuster JJ, Robison LL, Bernstein M, Weitzman S, et al. (April 2002). "Screening of infants and mortality due to neuroblastoma". The New England Journal of Medicine. 346 (14): 1041–6. doi:10.1056/NEJMoa012387. PMID 11932470.
- ^ Schilling FH, Spix C, Berthold F, Erttmann R, Sander J, Treuner J, Michaelis J (July 2003). "Children may not benefit from neuroblastoma screening at 1 year of age. Updated results of the population based controlled trial in Germany". Cancer Letters. 197 (1–2): 19–28. doi:10.1016/S0304-3835(03)00077-6. PMID 12880955.
- ^ Tsubono Y, Hisamichi S (May 2004). "A halt to neuroblastoma screening in Japan". The New England Journal of Medicine. 350 (19): 2010–1. doi:10.1056/NEJM200405063501922. PMID 15128908.
- ^ "Neuroblastoma Screening". National Cancer Institute. 1980-01-01. Archived from the original on 2008-10-01. Retrieved 2008-07-30.
- ^ Darshak Sanghavi, "Screen Alert: How an Ounce of RX Prevention can Cause a Pound of Hurt" Archived 2006-12-01 at the Wayback Machine, Slate magazine, November 28, 2006
- ^ Johnson E, Dean SM, Sondel PM (December 2007). "Antibody-based immunotherapy in high-risk neuroblastoma". Expert Reviews in Molecular Medicine. 9 (34): 1–21. doi:10.1017/S1462399407000518. PMID 18081947. S2CID 32358612.
- ^ Brodeur GM (March 2003). "Neuroblastoma: biological insights into a clinical enigma". Nature Reviews. Cancer. 3 (3): 203–16. doi:10.1038/nrc1014. PMID 12612655. S2CID 6447457.
- ^ Schulte JH, Horn S, Otto T, Samans B, Heukamp LC, Eilers UC, et al. (February 2008). "MYCN regulates oncogenic MicroRNAs in neuroblastoma". International Journal of Cancer. 122 (3): 699–704. doi:10.1002/ijc.23153. PMID 17943719.
- ^ "Translating Neuroblastoma Genomics to the Clinic—J. Maris presentation ASCO 2007". Archived from the original on 2009-01-02. Retrieved 2008-01-13.
- ^ Gisselsson D, Lundberg G, Ora I, Höglund M (September 2007). "Distinct evolutionary mechanisms for genomic imbalances in high-risk and low-risk neuroblastomas". Journal of Carcinogenesis. 6: 15. doi:10.1186/1477-3163-6-15. PMC 2042979. PMID 17897457.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Neuroblastoma Treatment". National Cancer Institute. 1980-01-01. Archived from the original on 2008-05-03. Retrieved 2008-02-02.
- ^ Haase GM, Perez C, Atkinson JB (March 1999). "Current aspects of biology, risk assessment, and treatment of neuroblastoma". Seminars in Surgical Oncology. 16 (2): 91–104. doi:10.1002/(SICI)1098-2388(199903)16:2<91::AID-SSU3>3.0.CO;2-1. PMID 9988866.
- ^ Fish JD, Grupp SA (January 2008). "Stem cell transplantation for neuroblastoma". Bone Marrow Transplantation. 41 (2): 159–65. doi:10.1038/sj.bmt.1705929. PMC 2892221. PMID 18037943.
- ^ Matthay KK, Villablanca JG, Seeger RC, Stram DO, Harris RE, Ramsay NK, et al. (October 1999). "Treatment of high-risk neuroblastoma with intensive chemotherapy, radiotherapy, autologous bone marrow transplantation, and 13-cis-retinoic acid. Children's Cancer Group". The New England Journal of Medicine. 341 (16): 1165–73. doi:10.1056/NEJM199910143411601. PMID 10519894.
- ^ Yu AL, Gilman AL, Ozkaynak MF, London WB, Kreissman SG, Chen HX, et al. (September 2010). "Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma". The New England Journal of Medicine. 363 (14): 1324–34. doi:10.1056/NEJMoa0911123. PMC 3086629. PMID 20879881.
- ^ Yalçin B, Kremer LC, van Dalen EC (October 2015). "High-dose chemotherapy and autologous haematopoietic stem cell rescue for children with high-risk neuroblastoma". The Cochrane Database of Systematic Reviews (10): CD006301. doi:10.1002/14651858.cd006301.pub4. PMID 26436598.
- ^ "Neuroblastoma Treatment". National Cancer Institute. 1980-01-01. Archived from the original on 2008-10-02. Retrieved 2008-07-30.
- ^ Yu AL, Gilman MF, Ozkaynak WB, London S, Kreissman HX, Chen KK, Matthay SL, Cohn JM, Maris JM, Sondel PM (2009). "A phase III randomized trial of the chimeric anti-GD2 antibody ch14.18 with GM-CSF and IL2 as immunotherapy following dose intensive chemotherapy for high-risk neuroblastoma: Childrens Oncology Group (COG) study ANBL0032". Journal of Clinical Oncology. 27 (15 Suppl): 10067z. Archived from the original on 2016-01-10. Retrieved 2015-09-10.
- ^ "Drugs Trials Snapshot: Danyelza". U.S. Food and Drug Administration (FDA). 25 November 2020. Retrieved 25 December 2020.
 هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ "Drug Approval Package: Danyelza". U.S. Food and Drug Administration (FDA). 22 December 2020. Retrieved 25 December 2020.
- ^ "Neuroblastoma overview". Children with Cancer UK. Retrieved 2020-07-01.
- ^ Kushner BH, Kramer K, LaQuaglia MP, Modak S, Yataghene K, Cheung NK (December 2004). "Reduction from seven to five cycles of intensive induction chemotherapy in children with high-risk neuroblastoma". Journal of Clinical Oncology. 22 (24): 4888–92. doi:10.1200/JCO.2004.02.101. PMID 15611504.
- ^ Kreissman SG, Villablanca JG, Diller L, London WB, Maris JM, Park JR, Reynolds CP, von Allmen D, Cohn SL, Matthay KK (2007). "Response and toxicity to a dose-intensive multi-agent chemotherapy induction regimen for high risk neuroblastoma (HR-NB): A Children's Oncology Group (COG A3973) study". Journal of Clinical Oncology. 25 (18 Suppl): 9505. doi:10.1200/jco.2007.25.18_suppl.9505. Archived from the original on 2016-01-10.
- ^ Ceschel S, Casotto V, Valsecchi MG, Tamaro P, Jankovic M, Hanau G, et al. (October 2006). "Survival after relapse in children with solid tumors: a follow-up study from the Italian off-therapy registry". Pediatric Blood & Cancer. 47 (5): 560–6. doi:10.1002/pbc.20726. PMID 16395684. S2CID 31490896.
- ^ Gurney JG, Tersak JM, Ness KK, Landier W, Matthay KK, Schmidt ML (November 2007). "Hearing loss, quality of life, and academic problems in long-term neuroblastoma survivors: a report from the Children's Oncology Group". Pediatrics. 120 (5): e1229-36. doi:10.1542/peds.2007-0178. PMID 17974716. S2CID 10606999.
- ^ Trahair TN, Vowels MR, Johnston K, Cohn RJ, Russell SJ, Neville KA, et al. (October 2007). "Long-term outcomes in children with high-risk neuroblastoma treated with autologous stem cell transplantation". Bone Marrow Transplantation. 40 (8): 741–6. doi:10.1038/sj.bmt.1705809. PMID 17724446.
- ^ Mozes, Alan (February 21, 2007). "Childhood Cancer Survivors Face Increased Sarcoma Risk". HealthDay. Archived from the original on September 8, 2015.
- ^ Oeffinger KC, Mertens AC, Sklar CA, Kawashima T, Hudson MM, Meadows AT, et al. (October 2006). "Chronic health conditions in adult survivors of childhood cancer". The New England Journal of Medicine. 355 (15): 1572–82. doi:10.1056/NEJMsa060185. PMID 17035650.
- ^ Laverdière C, Liu Q, Yasui Y, Nathan PC, Gurney JG, Stovall M, et al. (August 2009). "Long-term outcomes in survivors of neuroblastoma: a report from the Childhood Cancer Survivor Study". Journal of the National Cancer Institute. 101 (16): 1131–40. doi:10.1093/jnci/djp230. PMC 2728747. PMID 19648511.
- ^ Janoueix-Lerosey I, Schleiermacher G, Michels E, Mosseri V, Ribeiro A, Lequin D, et al. (March 2009). "Overall genomic pattern is a predictor of outcome in neuroblastoma" (PDF). Journal of Clinical Oncology. 27 (7): 1026–33. doi:10.1200/JCO.2008.16.0630. PMID 19171713.
- ^ Vandesompele J, Baudis M, De Preter K, Van Roy N, Ambros P, Bown N, et al. (April 2005). "Unequivocal delineation of clinicogenetic subgroups and development of a new model for improved outcome prediction in neuroblastoma" (PDF). Journal of Clinical Oncology. 23 (10): 2280–99. doi:10.1200/JCO.2005.06.104. PMID 15800319.
- ^ Michels E, Vandesompele J, Hoebeeck J, Menten B, De Preter K, Laureys G, et al. (2006). "Genome wide measurement of DNA copy number changes in neuroblastoma: dissecting amplicons and mapping losses, gains and breakpoints". Cytogenetic and Genome Research. 115 (3–4): 273–82. doi:10.1159/000095924. PMID 17124410. S2CID 14012430.
- ^ Carén H, Erichsen J, Olsson L, Enerbäck C, Sjöberg RM, Abrahamsson J, et al. (July 2008). "High-resolution array copy number analyses for detection of deletion, gain, amplification and copy-neutral LOH in primary neuroblastoma tumors: four cases of homozygous deletions of the CDKN2A gene". BMC Genomics. 9: 353. doi:10.1186/1471-2164-9-353. PMC 2527340. PMID 18664255.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Data and references for pie chart are located at file description page in Wikimedia Commons.
- ^ Brodeur GM, Hogarty MD, Mosse YP, Maris JM (1997). "Neuroblastoma". In Pizzo PA, Poplack DG (eds.). Principles and Practice of Pediatric Oncology (6th ed.). pp. 886–922. ISBN 978-1-60547-682-7.
- ^ Franks LM, Bollen A, Seeger RC, Stram DO, Matthay KK (May 1997). "Neuroblastoma in adults and adolescents: an indolent course with poor survival". Cancer. 79 (10): 2028–35. doi:10.1002/(SICI)1097-0142(19970515)79:10<2028::AID-CNCR26>3.0.CO;2-V. PMID 9149032.
- ^ Ladenstein R, Pötschger U, Hartman O, Pearson AD, Klingebiel T, Castel V, et al. (June 2008). "28 years of high-dose therapy and SCT for neuroblastoma in Europe: lessons from more than 4000 procedures". Bone Marrow Transplantation. 41 Suppl 2 (Suppl 2): S118-27. doi:10.1038/bmt.2008.69. PMID 18545256.
- ^ Berthold F, Simon T (2006). "Clinical Presentation". In Cheung NV, Cohn SL (eds.). Neuroblastoma. Springer. pp. 63–85. ISBN 978-3-540-26616-7.
- ^ Beckwith JB, Perrin EV (December 1963). "In Situ Neuroblastomas: A Contribution to the Natural History of Neural Crest Tumors". The American Journal of Pathology. 43: 1089–104. PMC 1949785. PMID 14099453.
- ^ Rothenberg AB, Berdon WE, D'Angio GJ, Yamashiro DJ, Cowles RA (February 2009). "Neuroblastoma-remembering the three physicians who described it a century ago: James Homer Wright, William Pepper, and Robert Hutchison". Pediatric Radiology. 39 (2): 155–60. doi:10.1007/s00247-008-1062-z. PMID 19034443. S2CID 19611725.
- ^ "Erin Buenger had a zest for living life fully". The Bryan College Station Eagle. April 12, 2009. Archived from the original on June 11, 2011.
- ^ أ ب ت Braekeveldt N, Wigerup C, Gisselsson D, Mohlin S, Merselius M, Beckman S, et al. (March 2015). "Neuroblastoma patient-derived orthotopic xenografts retain metastatic patterns and geno- and phenotypes of patient tumours". International Journal of Cancer. 136 (5): E252-61. doi:10.1002/ijc.29217. PMC 4299502. PMID 25220031.
- ^ Malaney P, Nicosia SV, Davé V (March 2014). "One mouse, one patient paradigm: New avatars of personalized cancer therapy". Cancer Letters. 344 (1): 1–12. doi:10.1016/j.canlet.2013.10.010. PMC 4092874. PMID 24157811.
- ^ Tentler JJ, Tan AC, Weekes CD, Jimeno A, Leong S, Pitts TM, et al. (April 2012). "Patient-derived tumour xenografts as models for oncology drug development". Nature Reviews. Clinical Oncology. 9 (6): 338–50. doi:10.1038/nrclinonc.2012.61. PMC 3928688. PMID 22508028.
- ^ "Neuroblastoma Committee—Current Focus of Research". Archived from the original on September 25, 2006. Retrieved 2008-01-13.
- ^ Baker DL, Schmidt ML, Cohn SL, Maris JM, London WB, Buxton A, et al. (September 2010). "Outcome after reduced chemotherapy for intermediate-risk neuroblastoma". The New England Journal of Medicine. 363 (14): 1313–23. doi:10.1056/NEJMoa1001527. PMC 2993160. PMID 20879880. Archived from the original on 2013-01-13.
- ^ Baker DL, Schmidt ML, Cohn SL, Maris JM, London WB, Buxton A, et al. (September 2010). "Outcome after reduced chemotherapy for intermediate-risk neuroblastoma". The New England Journal of Medicine. 363 (14): 1313–23. doi:10.1056/NEJMoa1001527. PMC 2993160. PMID 20879880.
- ^ Morgenstern DA, Baruchel S, Irwin MS (July 2013). "Current and future strategies for relapsed neuroblastoma: challenges on the road to precision therapy". Journal of Pediatric Hematology/Oncology. 35 (5): 337–47. doi:10.1097/MPH.0b013e318299d637. PMID 23703550. S2CID 5529288.
- ^ Illhardt T, Toporski J, Feuchtinger T, Turkiewicz D, Teltschik HM, Ebinger M, et al. (May 2018). "Haploidentical Stem Cell Transplantation for Refractory/Relapsed Neuroblastoma". Biology of Blood and Marrow Transplantation. Elsevier BV. 24 (5): 1005–1012. doi:10.1016/j.bbmt.2017.12.805. PMID 29307718.
External links
| Classification | |
|---|---|
| External resources |
- CS1 errors: unsupported parameter
- CS1 maint: unflagged free DOI
- الصفحات بخصائص غير محلولة
- Vague or ambiguous time from December 2020
- Articles with Curlie links
- Endocrine neoplasia
- Small-blue-round-cell tumors
- Brain tumor
- Dermal and subcutaneous growths
- Wikipedia medicine articles ready to translate
- Pediatric cancers