كربون
| |||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
نقي (الماس) & أسود (الجرافيت) الخطوط الطيفية للكربون | |||||||||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | الكربون, C, 6 | ||||||||||||||||||||||||||||||
| النطق | /ˈkɑrbən/ | ||||||||||||||||||||||||||||||
| تصنيف العنصر | غير فلزي | ||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14, 2, p | ||||||||||||||||||||||||||||||
| الوزن الذري القياسي | 12.0107(8) | ||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | 1s2 2s2 2p2 or [He] 2s2 2p2 2,4 | ||||||||||||||||||||||||||||||
| التاريخ | |||||||||||||||||||||||||||||||
| الاكتشاف | المصريون & السومريون[1] (3750 BC) | ||||||||||||||||||||||||||||||
| اعترف به كعنصر | أ. لاڤوازييه[2] (1789) | ||||||||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | amorphous:[3] 1.8–2.1 g·cm−3 | ||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | diamond: 3.515 گ·سم−3 | ||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | graphite: 2.267 گ·سم−3 | ||||||||||||||||||||||||||||||
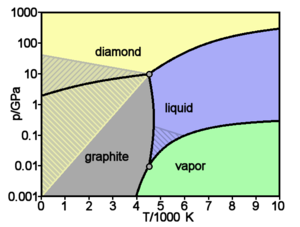
| نقطة التسامي | 3915 ك, 3642 °س, 6588 °ف | ||||||||||||||||||||||||||||||
| النقطة الثلاثية | 4600 ك (4327°س)، 10800[4][5] كپا | ||||||||||||||||||||||||||||||
| حرارة الانصهار | 117 (graphite) كج·مول−1 | ||||||||||||||||||||||||||||||
| السعة الحرارية المولية | 6.155 (diamond) 8.517 (graphite) ج·مول−1·ك−1 | ||||||||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||||||||
| حالات الأكسدة | 4, 3[6], 2, 1[7], 0, -1, -2, -3, -4[8] | ||||||||||||||||||||||||||||||
| سالبية كهربية | 2.55 (مقياس پولنگ) | ||||||||||||||||||||||||||||||
| طاقات التأين (المزيد) |
الأولى: 1086.5 كج·مول−1 | ||||||||||||||||||||||||||||||
| الثانية: 2352.6 كج·مول−1 | |||||||||||||||||||||||||||||||
| الثالثة: 4620.5 كج·مول−1 | |||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 77(sp³), 73(sp²), 69(sp) pm | ||||||||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 170 pm | ||||||||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||||||||
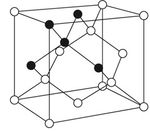
| البنية البلورية | diamond
(ألماس، نقي) (الجرافيت، أسود) | ||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | diamagnetic[9] | ||||||||||||||||||||||||||||||
| ناقلية حرارية | 900-2300 (الماس) 119-165 (الجرافيت) W·m−1·K−1 | ||||||||||||||||||||||||||||||
| التمدد الحراري | (25 °س) 0.8 (الماس)[10] µm·م−1·ك−1 | ||||||||||||||||||||||||||||||
| سرعة الصوت (قضيب رفيع) | (20 °س) 18350 (الماس) م·ث−1 | ||||||||||||||||||||||||||||||
| معامل ينگ | 1050 (الماس)[10] گپا | ||||||||||||||||||||||||||||||
| معامل القص | 478 (الماس)[10] گپا | ||||||||||||||||||||||||||||||
| معامل الحجم | 442 (الماس)[10] گپا | ||||||||||||||||||||||||||||||
| نسبة پواسون | 0.1 (الماس)[10] | ||||||||||||||||||||||||||||||
| صلادة موس | 10 (الماس) 1-2 (graphite) | ||||||||||||||||||||||||||||||
| رقم تسجيل كاس | 7440-44-0 | ||||||||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الكربون | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
الكربون Carbon /ˈkɑrbən/ (from لاتينية: carbo "coal") هو عنصر كيميائي ذو صفات لا معدنية واضحة، من عناصر الجدول الدوري ويوجد في الجدول الدوري في الفصيلة IVA (أو 4 ا). تشمل هذه الفصيلة إضافة إلى الكربون السيلسيوم، والجرمانيوم، والقصدير، والرصاص. يرمز له بالرمز C، وله عدد ذري 6. وهو من اللا فلزات, رباعي التكافؤ ومنتشر في الطبيعة بعدة أشكال:
- الماس:أقسى المعادن المعروفة، تتوزع فيه ذرات الكربون على زوايا هرم ثلاثي وذرة كربون في المركز. ترتبط فيه الذرات بتوزيع أربعة إلكترونات في مدارات sp3. مما يشكل بناءا قويا جدا ومترابطا في ثلاثة أبعاد .
- الجرافيت: أحد أكثر المواد ليونة، ترتبط فيه ذرات الكربون بثلاثة إلكترونات، مدار sp2 وإلكترون واحد في مدار s، ويكون شكلها مسطحا في بعدين. مما يشكل ما يشبه الصفائح الممتدة والمتراصة فوق بعضها البعض.
- الفوليرينات: جزيئات كبيرة متكونة من ذرات كربون مترابطة ثلاثيا تعطي شكل كريات (والتي تعتبر أفضل وأبسط الأشكال وتعرف باسم باكي بول).
- السيرافيت: (له سطح ناعم للغاية) لا يعرف تركيب شكله بدقة.
- الأيونسدالايت: (تشوهات من الماس) يماثل الماس في التركيب ولكن ببلورات سداسية.
- الكربون غير المتبلر: تجمعات من جزيئات الكربون في أشكال غير بلورية أو منتظمة, في حالة زجاجية.
- فقاعات الكربون الدقيقة: (شبكة مغناطيسية بالغة الدقة) شبكة قليلة الكثافة شبيهة بالجرافيت, حيث تترابط الذرات ثلاثيا في حلقات سداسية وسباعية.
- أنابيب الكربون الدقيقة: تترابط الذرات ثلاثيا في رقائق منحنية تشكل إسطوانات مفرغة.
المصابيح السوداء تتكون من مناطق جرافيت صغيرة. وهذه المناطق تكون موزعة عشوائيا, بحيث إن البناء الكلي يكون متماثلا.
الكربون الزجاجي متماثل الخواص) ويحتوى على نسبة عالية من المسامات المغلقة. وبعكس الجرافيت العادي, فإن الطبقات الجرافيتية ليست متراصة مثل الصفحات في كتاب ما, ولكن لها ترتيب عشوائي.
الألياف الكربونية تشبه الكربون الزجاجي. وتحت ظروف المعاملة الخاصة (شد الألياف الكربونية وكربنتها) فإنه يمكن ترتيب أسطح الكربون في إتجاه الألياف. وبالتعامد على محور الألياف لا يوجد توجيه لأسطح الكربون. وتكون الألياف الناتجة ذات قوة شد أكثر من الحديد.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
البنية الإلكترونية
بنيته الإلكترونية [He] 2s2 2P2، تدل [He] على البنية الإلكترونية للغاز الخامل الهليـوم. العـدد الذري للكربون 6، ووزنه الذري مقدراً بوحدة الكتل الذرية 12.011. له تكافؤان +2 و+4. والتكافـؤ +4، سواءَ كان ذلك بخسارة أو بإضافة أربعة إلكترونات استناداً إلى قاعدة «الثمانية»، هو الأثبت. ولتزايد حجم الذرات من أعلى الفصيلة إلى أسفلها؛ تتناقص قوة الجذب بين النواة وإلكترونات التكافؤ، مما يؤدي إلى نقص تدريجي في تقبل العناصر إلكترونات إضافية وتزايد سهولة التخلي عن الإلكترونات بالاتجاه نفسه. ولهذا يكون الكربون لا معدناً[ر. اللامعدن] دوماً، في حين يجمع السيلسيوم والجرمانيوم بين الصفات المعدنية واللامعدنية، ويكون للقصدير والرصاص خواص معدنية واضحة.
تتميز ذرة الكربون من العناصر الأخرى في فصيلته بعدم احتوائها على إلكترونات في المدار d، فيكون التكافؤ الأعظمي للكربون بالنسبة إلى الهالوجينات مساوياً 4 بمساهمة مدار s وثلاثة مدارات P.
التواجد
يتواجد الكربون في كل أشكال الحياة العضوية وهو أساس الكيمياء العضوية. كما أن هذا اللا فلز له القدرة على الاتحاد مع نفسه وعدد كبير من العناصر الأخرى, لإنتاج ما يقرب من 10 مليون مركب معروف. يتحد مع الأكسجين لتكوين ثاني أكسيد الكربون وهو مركب حيوي لنمو النبات. وعند اتحاده مع الهيدروجين, فإنه ينتج عديد من المركبات تسمى الهيدروكربونات, وهذه المركبات مهمة في الصناعات المختلفة كصناعة الوقود العضوي. وعند اتحاده مع كل من الأكسجين والهيدروجين فإنه ينتج مجموعات عديدة من المركبات منها الأحماض الدهنية, وهذه الأحماض أساسية للحياة, والإسترات التي تعطى النكهة لعديد من الفواكه. كما أن نظير الكربون كريون-14ٍٍ يستخدم في تحديد الزمن إشعاعيا.
يصادف الكربون في الطبيعة، حراً، بشكلين بلوريين: الألماس والغرافيت، كما أن للكربون أشكالاً متآصلة allotrope بلورية غير موجودة بالطبيعة وإنما تصطنع اصطناعاً، أكثرها شيوعاً البَكْمِنْسْتِرفولِّرين buckminsterfullerene. تتكوَّن جزيئاته من ستين ذرة كربون (صيغة الجزيء C60) وترتبط الذرات في الجزيء بعضها ببعض مكونة كرة، مثل كرة القدم؛ إذ إن الروابط بين الذرات تكون على شكل مضلعات سداسية وخماسية متصلة بعضها ببعض، كما وسمي هذا المركب نسبة إلى المعماري الأمريكي فولِّر R.Buckminster Fuller؛ لأن بنية الجزيء تشبه التصاميم الهندسية المعقدة التي صمَّمها هذا المعماري.
اكتشف C60 عام 1989؛ وهو أحد أفراد عائلة جديدة أُطلق عليها اسم ضروب الفولِّرين Fullerenes، وأصبح أكثرها شيوعاً البكمنسترفُولِّرين. وقد تم هذا الاكتشاف مصادفة حينما كان الأمريكي سمولي R.E.Smalley يعمل على اصطناع سلاسل خطية طويلة من ذرات الكربون. وقد وجّه سمولي أشعة ليزرية على قرص غرافيتي دوّار في غرفة مخلاّة من الهواء ومملوءة بالهليوم، فأدت شدة تسخين سطح الغرافيت وبسرعة إلى كسر الروابط C−C مما أدى إلى تناثر ذرات الكربون مصحوبة بتجمعات صغيرة منها، وعندما تبرد ذرات الكربون والتجمعات الذرية يتصادم بعضها ببعض وتنتج روابط جديدة بينها.
وأشكال جزيئات ضروب الفُولِّرين متنوعة: تراوح بين كرة قدم سطحها مكوَّن من مضلعات سداسية وخماسية متشابكه شبيهة بوحدات بناء جزيء C60 وبين أنابيب طويلة. وأنابيب النانو الكربونية أخذت اسمها لأنها جزيئات أسطوانية الشكل قطرها من مرتبة جزء من البليون من المتر (وهذا يساوي قطر ذرة ذات حجم متوسط، وطولها يساوي نحو ألف مرة قطرها) وهذه الجزيئات وزنها خفيف إلا أنها قد تكون أمتن نسيج صنِّع.
أما الكربون في الفحم الحجري، والفحوم الأخرى فغير بلوري عموماً. ويُصادف الكربون في الطبيعة على شكل غاز الكربون CO2 في الجو وأملاح كربونات معادن وبشكل أما الكربون في الفحم الحجري، والفحوم الأخرى فغير بلوري عموماً. ويُصادف الكربون في الطبيعة على شكل غاز الكربون CO2 في الجو وأملاح كربونات معادن وبشكل حجر كلسي أي كربونات الكالسيوم (في القشرة الأرضية). وبالرغم من أن الكربون لا يشكل أكثر من 0.1% من القشرة الأرضية فإنه العنصر الثاني (بعد الأكسجين) في تركيب الجسم البشري (16.5% كربون). وهو موجود في جميع الأنسجة الحيوانية والنباتية متحداً مع الهدروجين والأكسجين، وفي البقايا الجيولوجية لهذه الأنسجة (الفحم الحجري والبترول).
نصف قطر ذرة الكربون 0.91 أنغستروم، طاقة التشرد الأول 11.2 إلكترون فلط، الكهرسلبية 2.55، الكمون النظامي (إلى CO2) يساوي +0.20 فلط.
يُعرف للكربون نظيران هما: c12C ت(98.89%) و c13C ت(1.11%) كما يُعرف له نظير ثالث مشع c14C. ويحوي ثنائي أكسيد الكربون الموجود في الهواء الكربون 14 الذي يتكون نتيجة للتفاعل النووي بين ذرات آزوت (نتروجين) الهواء ونترونات الأشعة الكونية:
وفي عملية التمثيل اليخضوري يدخل الكربون 14 في تركيب النسج النباتية بحيث تكون نسبة عدد ذراته إلى عدد ذرات الكربون 12، وهو النظير المستقر للكربون، كنسبة 1 إلى 1210. غير أن هذه النسبة تتناقص مع الزمن إذا انقطع التبادل الحيوي في المادة النباتية (بفصل هذه المادة أو قطع النبات) بسبب تفكك الكربون 14 بإصدار أشعة β وفق التفاعل النووي:
وزمن نصف التفكك الإشعاعي (أي عمر النصف) للنظير 14 يساوي 5570 سنة تقريباً. ويستفاد من ذلك لتقدير عمر المادة النباتية بقياس إشعاع الكربون المكوّن لها. فعلى سبيل المثال، لتكن سرعة تحلل disintegration الكربون 14 في قطعة خشب حديثة القطع من شجرتها تساوي 15.6 تحلل في الدقيقة، في حين تساوي هذه السرعة 7.8 تحلل/دقيقة في قطعة خشب قديم لها وزن القطعة الأولى نفسه ويبلغ عمرها 5570 سنة تقريباً؛ أي إنه بتحديد سرعة تحلل الكربون 14 في كلتا القطعتين يمكن تعيين تاريخ قطع الخشب الثاني من شجرته بتقريب جيد.
ويوجد تقريبا 10 ملايين من المركبات المعروفة للكربون, وألاف منها أساسي للحياة وفى غاية الأهمية الإقتصادية. وهذا العنصر وفير في الشمس والنجوم والمذنبات وفى غلاف معظم الكواكب. كم أن بعض النيازك تحتوى على ماسات مجهرية تكونت عندما كان النظام الشمسي لايزال قرص كوكب أول. وبالإتحاد مع العناصر الأخرى, فإن الكربون يوجد في الغلاف الجوي, ويوجد أيضا كمادة مذابة في كل الأجسام المائية. وبكميات قليلة من الكالسيوم, والماغنسيوم, والحديد, فإنه المكون الأساسي في الكربونات, والصخور (الحجر الجيري, والدولميت, والرخام وهكذا). وعند إتحاده مع الهيدروجين, يكون الكربون الفحم, والنفط, والغاز الطبيعي ويطلق عليهم هيدروكربونات.
يوجد الجرافيت بكميات كبيرة في نيويورك وتكساس بالولايات المتحدة, كما يوجد أيضا في روسيا, والمكسيك, وجرين لاند, والهند.
أما الماس الطبيعي يوجد في الصخر البركاني كيمبرليت الذى يوجد في إمتدادات وفوهات البراكين القديمة. ومعظم نرسبات الماس توجد في أفريقيا, وخاصة جنوب أفريقيا, ناميبيا, بتسوانا, جمهورية الكونغو. كما يوجد أيضا في القطب الشمالي الروسي, [البرازيل]], وشمال وغرب أستراليا.
الصفات المميزة
الكربون عنصر مميز لأسباب عديدة. تتضمن أشكاله العديدة مادة من أنعم المواد (الجرافيت) ومادة من أقسى المواد (الماس). كما أن لها قابلية كبيرة للترابط مع الذرات الأخرى الصغيرة, بما فيها ذرات الكربون نفسه, وحجمه الصغير يجعله يستطيع تكوين روابط عديدة. ونظرا لذلك فإن الكربون يعرف أنه يكون ما يقرب من 10 ملايين مركب, أى معظم المركبات الكيميائية تقريبا. مركبات الكربون هى الأساس للحياة على الأرض كما أن دورة كربون-نيتروجين هى السبب في إصدرا بعض الطاقة الصادرة من الشمس والنجوم الأخرى.
لم يتكون الكربون خلال الإنفجار العظيم لأنه يتطلب تجمع ثلاثي لجسيمات ألفا (نواة الهيليوم) حتى ينتج. وفى الأصل تمدد الكون ثم برد بسرعة كبيرة حتى أصبح ذلك ممكنا. وبصفة عامة فإن الكربون أنتج في داخل النجوم بداخل الفرع الأفقي. كما انه أنتج أيضا في حالة عديدة الذرات.
| Synthetic nanocrystalline diamond is the hardest material known.[11] | Graphite is one of the softest materials known. |
| Diamond is the ultimate abrasive. | Graphite is a very good lubricant, displaying superlubricity.[12] |
| Diamond is an excellent electrical insulator.[13] | Graphite is a conductor of electricity.[14] |
| Diamond is the best known naturally occurring thermal conductor | Some forms of graphite are used for thermal insulation (i.e. firebreaks and heat shields) |
| Diamond is highly transparent. | Graphite is opaque. |
| Diamond crystallizes in the cubic system. | Graphite crystallizes in the hexagonal system.[15] |
| Amorphous carbon is completely isotropic. | Carbon nanotubes are among the most anisotropic materials ever produced. |
صفاته الكيمياوية
يختلف الكربون عن باقي عناصر فصيلته بكون عدده التساندي لا يتجاوز 4 (لعدم وجود مدارات d في الطبقة الثانية) وبمقدرته على تشكيل روابط مضاعفة (C≡N, C≡C, C==C) وسلاسل. وتكوين السلاسل يعني أن ذراته تترابط بعضها ببعض مكونة سلاسل. وتظهر هذه الخاصة في الملايين من مركبات الكربون سواء الموجودة في الطبيعة أو مركباته المصطنعة في المختبرات. ومركبات الكربون كثيرة جداً لذلك أُفرِد لدراستها فرع خاص في الكيمياء هو الكيمياء العضوية. وللكربون أيضاً مركبات بسيطة مثل CO وCO2 وضروب الكربونات وغيرها.
الكربون، بشكليه الماس والجرافيت، خامل كيمياوياً بدرجة الحرارة العادية. أما في الدرجات العالية من الحرارة فهو يتفاعل مع أغلب العناصر المعدنية واللامعدنية. والكربون غير البلوري أكثر نشاطاً (فاعلية) من الجرافيت والماس.
يكوِّن الكربون مع الأكسجين أكسيدين هما أحادي أكسيد الكربون CO وثنائي أكسيد الكربون CO2، إضافة إلى أكاسيد أخرى غير شائعة مثل C3O2 وC5O2 وC12O9.
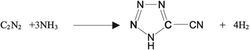
وللكربون مع الكبريت مركب كبريتيد الكربون CS2 الذي ينتج من تفاعل الكربون اللابلوري (الكوك والفحم الخشبي) المسخّن مع بخار الكبريت. ويتفاعل الكربون مع الآزوت بدرجة عالية من الحرارة مكوّناً C2N2 (السيانوجين) وهذا التفاعل ماص للحرارة ولا يجري إلا بصورة محدودة. ويكوّن الكربون مع الهالوجينات مركبات من نوع CX4. يمكن استحصال CF4 بالتفاعل المباشر بين الكربون وغاز الفلور على خلاف المركبات المماثلة التي لا تحضر إلا بطرق غير مباشرة.
لا يتفاعل الكربون مع المعادن إلا بدرجات حرارة عالية. ويعدّ ثنائي كربيد الكالسيوم CaC2 وكربيد التنجستين WC وكربيد ثنائي التنجستين W2C من أهم مركبات الكربون مع المعادن.
أكاسيد الكربون وحموضه
أحادي أكسيد الكربون CO هو بلا ماء حمض النمل (الفورميك) HCOOH. وهو في الظروف الطبيعية، غاز لا لون له ولا رائحة، تساوي كتلته الحجمية 1.25غ/لتر، أما كثافته النسبية (مقارنة بالهواء) فتساوي 0.967. وهو قليل الانحلال في الماء (35سم3/ل عند الدرجة صفر سلسيوس مئوية). ولا يتفاعل مع الماء أو الحموض أو الأسس. وهو سام جداً إذ يتحد مع هيموجلوبين الدم ويشكل مركباً معقداً يمنع الدم من التفاعل مع الأكسجين. لذا يؤدي استنشاق الهواء الملوث بأحادي أكسيد الكربون إلى تسمم متفاوت الخطورة حسب تركيز الغاز CO في الهواء وطول فترة الاستنشاق (الشكل-3).
يقوم أحادي أكسيد الكربون بتفاعلات ضم وتفاعلات إرجاع، إلا أن هذه التفاعلات لا تتم إلا بدرجات عالية من الحرارة. فهو يتفاعل مع الأكسجين، ومع الهالوجينات، والكبريت ومع بعض المعادن أيضاً مكوّناً مركبات ضم.
يحترق بأكسجين الهواء بدرجة 700 س بلهب أزرق وينتج ثنائي أكسيد الكربون:
وتنتشر كمية حرارة قدرها 564.3 كيلو جول، ولذلك يستعمل وقوداً لدفع الصواريخ والمركبات الفضائية لضخامة كمية الحرارة الناتجة من هذا التفاعل.
يتحد مع الهالوجينات مكوّناً مركبات صيغتها COX2 كما يتحد مع الكبريت مكوّناً كبريتيد الكربونيل COS. ويرجِع أكاسيد معدنية عدة بدرجات مرتفعة من الحرارة؛ ويستعمل لهذا الغرض في عمليات تعدين لإرجاع كثير من الأكاسيد مثل CuO، وAg2O، وFe2O3.
ثنائي أكسيد الكربون (غاز الكربون) CO2 غاز لا لون له، وله طعم حمضي خفيف، وهو قليل الانحلال في الماء، ويزداد انحلاله بزيادة الضغط مما يفسر استعماله في المشروبات الغازية.
يتحول غاز الكربون CO2 إلى سائل تحت ضغط يناهز 60 جواً وبدرجة الحرارة العادية. ويمتص ثنائي أكسيد الكربون السائل كمية كبيرة من الحرارة عندما يتبخر مما يؤدي إلى انخفاض في درجة حرارة السائل الباقي وتحوله إلى جسم صلب أبيض يشبه الثلج. يتسامى ثنائي أكسيد الكربون الصلب ببطء بالدرجة -78 ْس تحت الضغط الجوي. يحتوي الجو على 0.03% حجماً من غاز الكربون وهو غير سام إلا إذا وجد بنسبة عالية جداً. وهو مركب ثابت لا يتفكك إلا بتسخينه إلى 2000 ْس على الأقل.
يستعمل CO2 في الحالة السائلة تحت ضغط مرتفع في أجهزة الإطفاء لعدم قابليته للاحتراق أو الإحراق، كما أنه يبرد الأجسام المشتعلة ويفصلها عن الأكسجين لكثافته العالية. ومن مزايا الإطفاء بغاز الكربون أنه يتبخر من دون أن يترك آثاراً في الأجسام المجاورة.
ينحل ثنائي أكسيد الكربون في الماء بمقدار 0.04 مول في اللتر في الشروط العادية ويكون 99.63% منه على شكل جزيئات CO2 والباقي على شكل H2CO3. وللمحلول الناتج خاصة حمضية إذ تبلغ قيمة قوة الحموضة (الباهاء) pH ت 3.8. تفسَّر هذه الخاصة بالتفاعل الجزئي بين غاز الكربون والماء وتشكل حمض الكربون H2CO3 :
يكوّن حمض الكربون نوعين من الأملاح عندما يتفاعل مع محاليل أساسية: أملاح حمضية محتوية على الأيون وأملاح معتدلة محتوية على أيون الكربونات وأملاح الكربونات ضعيفة الانحلال في الماء باستثناء كربونات الصوديوم والبوتاسيوم والأمونيوم.
أما أملاح الكربونات الحمضية فتنحل في الماء أكثر من انحلال الأملاح المعتدلة، وتكون لمحاليل هذه الأملاح خاصة قاعدية (أساسية) كما أنها تسلك سلوك أملاح الكربونات المعتدلة نفسه مع الحموض القوية.
يقوم الغلاف الجوي بدور مخزن لثنائي أكسيد الكربون. ففي أثناء الاصطناع الضوئي، تحوِّل النباتات الغاز إلى سكاكر ومن ثم إلى جزيئات أعقد. والحيوانات التي تستهلك النباتات تدمج مركبات كربونية عديدة مدخلة إياها في بناها أو تستعملها منبعاً طاقياً. ويرجع ثنائي أكسيد الكربون إلى الجو بطرق عدة، فبعضه تزفره الحيوانات في أثناء تنفسها، وينطلق قسم منه نتيجة تلف المركبات العضوية. كما ينطلق CO2 إلى الجو نتيجة احتراق الوقود مثل الخشب والخُث والفحم والبترول، ومعظم O2 المنطلق بهذه الطريقة سببه الإنسان: للتدفئة، وطبخ الطعام، وتسيير المركبات، وللاستعمال في الصناعة.
ازداد تركيز ثنائي أكسيد الكربون في القرون الماضية في الغلاف الجوي ازدياداً بطيئاً، ولكن ازداد هذا التركيز سريعاً منذ السنوات العشرين الأخيرة من القرن العشرين للازدياد الهائل في عدد سكان الأرض، ما أدى إلى زيادة انبعاثات غاز الكربون، ولاسيما نتيجة احتراق الوقود. وهذه الزيادة أكبر مما يمتصه النبات أو يذوب في المحيطات. وإحدى نتائج زيادة هذا الغاز هو مفعول الدفيئة. فالضوء المرئي أو الأشعة فوق البنفسجية الصادرة عن الشمس تصل إلى سطح الأرض فوتوناتٍ أطوال أمواجها قصيرة. يصدر الإشعاع من سطح الأرض بمجال الأشعة تحت الحمراء التي هي ذات أمواج أطول بكثير. ويمتص غاز الكربون CO2 كمية مميزة من هذا الإشعاع، وهكذا كلما ازدادت كمية هذا الغاز في الجو قلَّت الطاقة المتسربة إلى الفضاء. وينجم عن ذلك أن درجة حرارة الجو ترتفع. ومن الملاحظ فعلاً أن وسطي درجات حرارة الجو بدأت بالارتفاع، وسيكون لذلك تأثير ملحوظ على المناخ. ويصعب تحليل المفعول الدقيق لزيادة تركيز غاز الكربون لأن النظام الجوي معقد لدرجة كبيرة، أما إذا استمر ارتفاع درجة الحرارة، فمن المؤكد حصول تغيرات جذرية.[16]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
سلاسل الكربون
تتكون الهيدروكربونات من سلاسل من ذرات الكربون, مشبعة بذرات الكربون. وتكون الزيوت المتطايرة لها سلاسل قصيرة. بينما الدهون لها سلاسل أطول, والشمع له سلاسل أكثر طولا.
النظائر
 مقالة مفصلة: نظائر الكربون
مقالة مفصلة: نظائر الكربون
للكربون نظيرين طبيعيين مستقرين هما كربون-12 او 12C ويشكل 98.89% من مجموع الكربون في الطبيعة والنظير كربون-13 او 13C والذي يشكل 1.11% كما ان للكربون نظير غير مستقر يظهر في الطبيعة هو الكربون-14 او14C . يوجد 15 نظير معروف للكربون وأقلهم عمرا 8C الذى يضمحل عن طريق إنبعاث بروتون وإضمحلال ألفا. وله فترة عمر نصف تبلغ 1.98739x10-21 ثانية.
في عام 1961 قام الاتحاد الدولي للكيمياء المجردة والتطبيقية ([IUPAC]) ، بتبنى النظير كربون-12 كأساس لقياس الكتل الذرية.
للكربون-14 له عمر نصف مقداره 5715 عام، وهو يستخدم بشكل كبير لقياس تحديد الزمن إشعاعيا للأخشاب ، علم الآثار، الحفريات.
تشكيل النجوم
 مقالات مفصلة: Triple-alpha process
مقالات مفصلة: Triple-alpha process- CNO cycle
دورة الكربون
 مقالة مفصلة: دورة الكربون
مقالة مفصلة: دورة الكربون
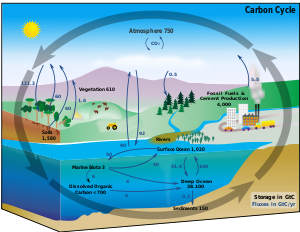
فى الظروف العادية من النادر تحول نظير من نظائر الكربون للأخر. وعلى هذا, فإنه ولهدف معين فإن نسبة الكربون. وعلى ذلك فإن العمليات التى تستهلك الكربون يجب أن تحصل عليه من مصدر أخر, وتتخلص منه في مكان أخر. والطرق التى يسلكها الكربون في الطبيعة تسمى دورة الكربون. فمثلا, تسحب النباتات الكربون من الهواء في صورة ثناى أكسيد الكربون وتستخدمه لبناء نفسها. وبعض هذه النباتات تؤكل عن طريق الحيوانات, التى يتنفس بعضها ويطلق ثانى أكسيد الكربون. ودورة الكربون معقدة وليست بسيطة كما قد يبدو في هذا المثال البسيط, فمثلا يذوب بعض ثانى أكسيد الكربون في المحيطات, كما ان النباتات والحيوانات الميتة يمكن أن تتحول إلى أحجار رسوبية, وهكذا.
المركبات
 مقالة مفصلة: مركبات الكربون
مقالة مفصلة: مركبات الكربون
من أكثر مركبات الكبريت مع الكربون شيوعاً ثنائي كبريتيد الكربون CS2، وهو سائل بالشروط العادية إلا أنه يتبخر بسهولة ابتداء من الدرجة 46 ْس وهو لا لون له ولا ينحل في الماء. بخاره سام، وهو يشتعل بسهولة ويحترق في الأكسجين حسب التفاعل:
وهو محل جيد للشحوم والزيوت والمطاط واليود والكبريت والفسفور. لذلك يستعمل لاستخلاص المركبات الدسمة من المواد الطبيعية كما أنه يستعمل بكثرة في صناعة النسيج (تحضير الحرير الاصطناعي) وفي مكافحة الحشرات.
سيانيد الهدروجين HCN سائل سام جداً (يكفي 50مغ منه لقتل إنسان في بضع ثوان)، لا لون له سهل التطاير ذو رائحة خاصة، ينصهر بالدرجة - 13 ْس ويغلي بالدرجة 26 ْس. محلوله في الماء حمضي. يستعمل، بصفة رئيسة في تحضير المركبات العضوية، في حين تدخل أملاحه في عملية استخلاص الذهب من خاماته الفقيرة.
السيانوجين C2N2 غاز لا لون له رائحته تشبه رائحة اللوز المر وهو سام جداً. تبلغ درجة انصهاره -34.4 ْ س ودرجة غليانه -21 ْْس. ينحل السيانوجين ببطء وبكمية صغيرة في الماء أو الكحول أو الإيتر. يستعمل السيانوجين في كثير من التفاعلات العضوية؛ مثال ذلك تفاعله مع النشادر:
يعد رباعي كلوريد الكربون CCl4 أهم المركبات الهالوجينية للكربون، وهو - في الشروط الطبيعية - سائل لا لون له ذو رائحة خاصة قليل الانحلال في الماء (0.8غ في اللتر بالدرجة 20 ْس). ويتميز بخموله الكيمياوي الملحوظ. يستعمل مذيباً للشحوم والزيوت والراتنجات. ويستعمل مادة منظفة وهو يفضل على ثنائي كبريتيد الكربون CS2 إذ إنه غير قابل للاشتعال، فاستعماله، لذلك، أقل خطورة عملياً ويستخدم CCl4 في إطفاء الحرائق ومخدراً في الطب.
المركبات العضوية
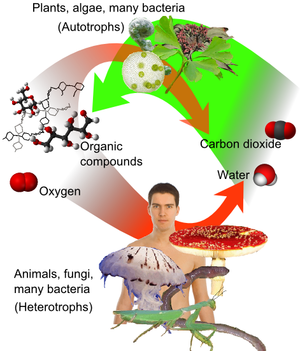
أشهر أكاسيد الكربون على الإطلاق هو ثاني أكسيد الكربون CO2. وهو عنصر قليل من مكونات الغلاف الجوي, ويتم إنتاجه وإستهلاكه عن طريق الكائنات الحية. ويقوم ثانى أكسيد الكربون بتكوين حمض الكربونيك (H2CO3) بكميات قليلة في الماء, ولكن مثل معظم مركبات الكربون التى يكون بها كثير من الروابط الأحادية على مع الأكسجين على ذرة كربون واحدة فإنه لا يكون ثابت. وعلى هذا فإنه يكون هناك حالات وسيطة, وخلال هذه الحالات الوسيطة تنتج أيونات الكربونات. وهنام كثير من الأملاح على هيئة كربونات, ومن اهمها الكالسيت. ثانى كبريت الكربون CS2 أيضا من الكربونات المهمة.
ومن الأكاسيد الأخرى أول أكسيد الكربون CO, والأكسيد الغير عادي للكربون C3O2. يتكون أول أكسيد الكربون بالإحتراق الغير كامل, وهو عديم اللون, والرائحة. وتحتوى هذه الجزيئات التى تحتوى على رابطة ثلاثية وهى جزيئات قطبية إلى حد ما, مما يؤدى لميلها للإرباط بجزيء الهيموجلبين, وعلى هذا فإن أول أكسيد الكربون من الغازات السامة. السيانيد CN-, له بناء مماثل ويتصرف مثل أيون الهاليدات, النيتريد (السيانوجين) (CN)2 أيضا متضمن في ذلك.
ومع الفلزات القلوية يكون الكربون إما الكاربيدات C-, أو أسيتيليدات C22-, وهذه تكون مع الميثان والأسيتيلين, وكلاهما حمض ضعيف. وكلهم له سالبية كهربيية 2.5, مثل الكاربوروندوم SiC, الذى يشبه الماس.
مركبات غير عضوية
المركبات الفلزية العضوية
 مقالة مفصلة: الكيمياء الفلزية العضوية
مقالة مفصلة: الكيمياء الفلزية العضوية
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تاريخ الكربون والتسمية

الكربون ("كربو" تعني باللغة اللاتينية "فحم") تم إكتشافه في عصور ما قبل التاريخ وكان معروف عند القدماء, الذين حصلوا عليه بحرق المواد العضوية بمعزل عن الاكسجين لتصنيع الفحم. كما أن الماس يعتبر منذ القدم من المواد النادرة. ومن الصور الأخيرة المكتشفة لتآصلات الكربون فوليرين, والتى تم إكتشافها كمنتج ثانوي أثناء تجارب الشعاع الجزيئي في الثمانينات من القرن العشرين.
قبل ملايين السنين، عندما كان مناخ الأرض أشد رطوبة وأكثر أمطاراً مما هو عليه في الوقت الحالي، كانت المملكة النباتية في ازدهار رائع. وكانت هذه النباتات وما ينتج منها من أوراق وأزهار تختلط بالمواد الرسوبية وتتوضع في المستنقعات أو التجمعات المائية، وتتفسخ بعيدة عن أكسدة الهواء، منقلبة إلى نوع من الفحم يحتفظ بكثير من صفاته النباتية يطلق عليه اسم التورب. وتمر على التورب عوامل جيولوجية متنوعة ويتعرض في باطن الأرض إلى ضغط وحرارة شديدين، ويتحول تدريجياً إلى طبقات من الفحم الحجري تختلف أنواعه باختلاف عمره وما عاناه من حوادث. ويُصادَف اللغنيت- وهو حديث المنشأ ولا يزال بني اللون- في مناطق متعددة من الأرض. وهناك الفحم الحجري العادي الذي يسمى الفحم الدسم، وهو النوع المستعمل بكثرة في الصناعة. أما الأنتراسيت فهو نوع قديم العهد كامل التفحم، أندر وجوداً من الفحم الدسم وأنفع منه في الاستعمال المنزلي إذ لا تتسخ به اليد ولا ينشر دخاناً عند احتراقه. يلخص الجدول (1) تركيب هذه الأنواع من الفحوم والسلولوز والخشب والبترول والنفط، كما يبين حرارة احتراق هذه الأنواع.
الوقود كربون هدروجين أكسجين حرارة الاحتراق (حريرة/غرام) سلولوز 44.5% 6.2% 49.3% 4200 خشب 50.0 6.0 44.0 4100 تورب 60.0 5.9 34.1 5500 ليغنيت 67.0 5.2 27.8 6500 فحم دسم 88.4 5.6 6.0 8300 أنتراسيت 94.1 3.4 2.5 8700 نفط 58.5 14.2 0.3 11000
الإرتباط بالكربون
| CH | He | ||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | ||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | ||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | |
| Fr | CRa | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| ↓ | |||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | |||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | |||
| Core organic chemistry | Many uses in chemistry |
| أبحاث أكاديمية لكن لم ينتشر استخدامها | رابطة غير معلومة |
المتآصلة
 مقالة مفصلة: متآصلة الكربون
مقالة مفصلة: متآصلة الكربون
تآصل الكربون النقي يختلف عن تآصل التركيبات الجزيئية الأخرى له.
الثلاث تآصلات المعروفة للكربون هم الكربون الغير متبللر, والجرافيت. والماس. كما تم تصنيع وإكتشلف عدد من ثور التآصل الشاذة الأخرى ومنها الفوليرينات, أنابيب الكربون الدقيقة, واللونسداليت.
فى شكله الغير متبللر, يكون الكربون في الأساس جرافيت ولكن لا يتواجد في شكل متبللر كبير. ولكن يتواجد في شكل مسحوق والذى يكون المكون الرئيسي للمواد مثل الفحم, السناج, سخام, كربون منشط.
فى الضغط العادى يأخذ الكربون شكل الجرافيت, وفيه ترتبط كل ذرة مع ثلاث ذرات في مستوى يتكون من شكل سداسي في كل الحلقات. مثل الحلقات الموجودة في الهيدروكربونات الأروماتية. الشكلان المعروفان للجرافيت, ألفا (سداسي) و بيتا (منشور سداسي منتظم), وكلاهما له خواص فيزيائية متطابقة, فيما عدا البناء البللوري. ويحتوى الجرافيت الذى يتواجد بصورة طبيعية على 30 % تقريبا من الشكل بيتا, وعند تصنيع الجرافيت فإنه يحتوى فقط على الشكل ألفا. ويمكن للشكل ألف أن يتحول إلى الشكل بيتا بالمعالجة الميكانيكية ويرجع الشكل بيتا إلى الشكل ألفا عند تسخينه فوق 1000 C °
وبسبب عدم تمركز سحابة-باي, فإن الجرافيت يوصل الكهرباء. الجرافيت مادة طرية ورقاقتها, تفصل كتيرا بالذرات الأخرى, وتمسك مع بعضها البعض عن طريق قوى فان دير فال, وبالتالى فإنها تنزلق بسهولة على بعضها البعض.
وفى الضغوط العالية يكون الكربون صورة من صور تآصله تسمى الماس, والتى ترتبط فيها كل ذرة لأربعة ذرات أخرى. وللماس نفس البناء المكعب للسيليكون والجيرمانيوم, ونظرا لقوة الرابطة بين كربون-كربون, فإنه مع نيتريد البورون متساوي الإلكترونات (BN) أقصى المواد من حيث مقاومة الخدش. التحولات التى تحدث للجرافيت في درجة حرارة الغرفة بطيئة للغاية لأن تلاحظ. وتحت بعض الظروف, يتبللور الكربون لللونسدالايت وهو شكل مشابه للماس ولكن سداسي.
الفوليرينات لها بناء يماثل الجرافيت, ولكن بدلا من الشكل السداسي النقي, فإنها تحتوى على أشكال خماسية (وإحتمال سباعية) من ذرات الكربون, مما يؤدى لإنثناء الطبقات إلى كريات أو إسطوانات. خواص الفوليرينات (تسمى أيضا "كرة بوكي" و "أنبوبة بوكي") لم يتم تحليلها حتى الأن. وكل أسماء الفوليرينات تم تسميتها على شرف بوكوينستر فوللير, مطور قبة جيوديسي والتى تسبه بناء كرة بوكي.
تآصل فقاعة دقيقة تم إكتشافه مؤخرا وهو مغناطيسي حديدي.
صور الكربون المتآصلة تتضمن:
- الكربون الغير متبللر
- فقاعة كربون دقيقة (تم إكتشافه عام 1997)
- أنبوبة كربون دقيقة
- الماس
- فوليرين
- جرافيت
- أيونسدالايت
- سيرافيت
نظام تآصل الكربون يتسع لمدى كبير للغاية.
بين الماس والجرافيت:
- الماس أصلب المعادن المعروفة للإنسان, ولكن الجرافيت أيضا من أكثرها طراوة.
- الماس مادة كاشطة, بينما الجرافيت مادة مزيتة.
- الماس عازل ممتاز للكهرباء,بينما الجرافيت يوصل الكهرباء.
- الماس غالبا شفاف, بينما الجرافيت معتم.
- الماس له شكل بللوري مكعب, بينما الجرافيت شكله البللورى سداسي.
بين الكربون الغير متبللر والأنابيب الدقيقة:
- الكربون الغير متبللر هو من أسهل المواد التى يمكن تصنيعها, بينما كربون الأنابيب الدقيقة يحتاج لنفقات باهظة لتصنيعه.
- الكربون الغير متبللر موحد الخواص, ولكن كربون الأنابيب الدقيقة من ضمن أكثر المواد المتباينة الخواص على الإطلاق.
الإنتاج
الجرافيت
 مقالة مفصلة: الجرافيت
مقالة مفصلة: الجرافيت
يتحول الغرافيت بتأثير الضغط العالي والحرارة العالية إلى ماس وقد أمكن صنع الماس بهذه الطريقة، ويستعمل في أغراض صناعية فقط.
وفي الجرافيت تشكل الذرات طبقات مستوية ويكون ترتيب الذرات في الطبقة الواحدة على هيئة مضلعات سداسية منتظمة، ترتبط كل ذرة كربون فيها بثلاث ذرات أخرى فيمكن اعتبار حصول تهجين من النمط SP2. تبلغ المسافة بين مستويين متجاورين 2.40 أنجستروم، ما يدل على أن المستويات لا ترتبط فيما بينها بروابط مشتركة وإنما بقوى من نوع ڤان درفالس. كتلته الحجمية 2.25غ/سم3، ودرجة انصهاره 3500 ْس ودرجة غليانه4830 ْس.
الجرافيت ذو لون غامق وعاتم يتصف ببريق معدني، أما الناقلية الكهربائية له فكبيرة (1/1000 من ناقلية النحاس) في الاتجاه الموازي لمستويات الذرات، وهي صغيرة في الاتجاه العمودي على المستويات. فيبدو أن الرابطة المتعددة المراكز في المستويات تشبه نموذج الارتباط في المعادن، حيث يوجد بحر من الإلكترونات (إلكترونات π في الغرافيت). ويعزى البريق المعدني والناقلية الكهربائية للجرافيت إلى سهولة تحرك هذه الإلكترونات.
أما بنية الجرافيت فلا تصادف إلا في الكربون ويعزى ذلك إلى قدرة الكربون على تشكيل روابط مضاعفة.
تنـزلق بلورات الجرافيت بعضها على بعض عند حك الجرافيت فوق قطعة من الورق مثلاً. ولذلك يستعمل في صنع أقلام الرصاص. ويمكن استحضار الجرافيت صناعياً بتسخين الفحم حتى الدرجة 3500 ْس. وبسبب ليونته ومقاومته للحرارة يستعمل في تشحيم بعض الآلات المعرَّضة للحرارة العالية. ويستعمل عاملاً مرجعاً لاستحصال المعادن، وتصنع منه إلكترودات في الاستحصال الكهركيمياوي للعناصر، كما يستعمل معدِّلاً في المفاعلات النووية وفي صنع الألياف الكربونية عالية القوة.
وقد تبين بنتيجة الدراسة بوساطة الأشعة السينية أن للكربون اللابلوري بنية الجرافيت إلا أن سطحه ذو مسام كثيرة.
الماس
 مقالة مفصلة: الماس
مقالة مفصلة: الماس
للماس خاصتان مهمتان. الأولى قساوته الشديدة فهو أقسى مادة معروفة. والخاصة الثانية التي تميز الماس (أو الألماس) قرينة انكساره العالية التي تساعد على انكسار الضوء وظهور بريق الماس المعروف. ويتبلور كل من Si وGe وSn حسب البنية البلورية للماس.
التطبيقات



الماس
الإستخدامات
الكربون مكون أساسي لكل الأنظمة الحية, وبدونه لا يمكن أن تتواجد الحياة كما نعرفها (شاهد أحياء اللا كربون).الهيدروكربونات هى أكثر الإستخدامات الإقتصادية للكربون, وأكثرها شيوعا الوقود العضوي, مثل غاز الميثان والنفط (البترول). يتم تطبيق تقنيات الصناعة النفطية على النفط الخام لإنتاج عديد من المركبات منها البنزين والكيروسين, خلال عمليات التقطير, في معامل التكرير. كما أن النفط الخام يعتبر المادة الأولية لعديد من المواد التصنيعية, ومنها اللدائن.
إستخدامات اخرى
|
الخواص الكيميائية والبنائية للفوليرينيس (احد اشكال الكربون)، والتي تكون على شكل انابيب متناهية الدقة (تقاس بالنانومتر) مؤهلة للإستخدام في التكنولوجيا المتناهية الصغر ( تكنولوجيا النانو ) الناشئة.
الإحتياطات
الكربون أمن نسبيا. ولكن إستنشاق السخام بكميات كبيرة يمكن أن يكون خطر. ويمكن للكروبن أن يشتعل في درجات الحرارة العالية للغاية ويحترق بشدة كما في [[حريق ويندسكال].
ونظرا لوجود عدد هائل من مركبات الكربون, بعضها سام للغاية مثل سيانيد CN-, وبعضها أساسي للحياة مثل ديكستروز, ويعضها يمكن يكون الإثنين معا مثل [بثاني أكسيد الكربون]] CO2.
انظر أيضاً
المصادر
- ^ "History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky". Caer.uky.edu. Retrieved 2008-09-12.
- ^ Senese, Fred (200-09-09). "Who discovered carbon?". Frostburg State University. Retrieved 2007-11-24.
{{cite web}}: Check date values in:|date=(help) - ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Carbon. 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ^ Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Carbon. 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ^ Fourier Transform Spectroscopy of the System of CP. Retrieved on 2007-12-06.
- ^ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical. Retrieved on 2007-12-06.
- ^ Carbon: Binary compounds. Retrieved on 2007-12-06.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ أ ب ت ث ج Properties of diamond, Ioffe Institute Database
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). "Materials: Ultrahard polycrystalline diamond from graphite". Nature. 421 (6923): 599–600. doi:10.1038/421599b. PMID 12571587.
- ^ Superlubricity of Graphite Martin Dienwiebel, Gertjan S. Verhoeven, Namboodiri Pradeep, Joost W. M. Frenken, Jennifer A. Heimberg, and Henny W. Zandbergen Phys. Rev. Lett. 92, 126101 (2004) doi:10.1103/PhysRevLett.92.126101 [1]
- ^ Collins, A.T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ^ Deprez, N.; McLachan, D. S. (1988). "The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction". Journal of Physics D: Applied Physics. Institute of Physics. 21 (1). Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015. Retrieved February 29, 2012.
- ^ Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 90-5699-228-7.
- ^ هيام بيرقدار. "الكربون". الموسوعة العربية.
- تحولات الجرافيت في درجات الحرارة العالية والضغط العالي وتم حثه بإمتصاص شعاع LHC , J.M. Zazula, 1997
- WebElements.com and EnvironmentalChemistry.com per the guidelines at Wikipedia's WikiProject Elements
وصلات خارجية
- Carbon on In Our Time at the BBC. (listen now)
- قالب:PeriodicVideo
- Carbon on Britannica
- Extensive Carbon page at asu.edu
- Electrochemical uses of carbon
- Carbon – Super Stuff. Animation with sound and interactive 3D-models.
- معمل لوس ألاموس القومي - كربون
- مقالة عن الطبيعةمقالة عن الطبيعة
- العناصر على شبكة المعلومات -كربون
- إنه أساسي:الكربون
- - الكربون والفوليرين وصور اخرى متآصلة - ڤنسنت هر
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||