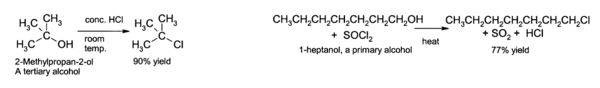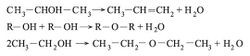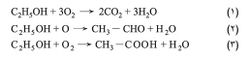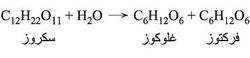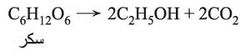كحول
الكحول Alcohol أو الغول هو مصطلح يطلق في الكيمياء العضوية على جميع المركبات التي تحتوي وظيفة الهيدروكسيل مرتبطة بسلسلة هيدروكربونية مفتوحة أو حلقية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التسمية
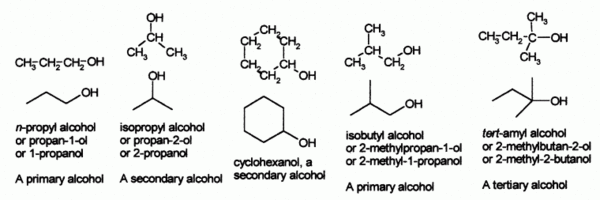
الأغوال أو الكحولات مركبات عضوية تحتوي على زمرة OH واحدة أو أكثر لها الصيغة العامة ROH، يمثل R جذر سلسلة أليفاتية مفتوحة أو حلقية، مشبعة أو غـير مشبعة. إن المركبات التي ترتبط فيها زمـرة الهدروكسيل مباشرة بحلقة عطريـة لا تنتمي إلى الأغـوال وإنما إلى مركبـات ضـروب الفينول. شاعت كلمة غول المعرّفة من دون صفة (الغول، الكحول) للإشارة إلى المركب C2H5OH (غول الإيتيل أو الإيتانول أو ميتيل الكربينول). والكحول تعريب لكلمة الغول الواردة في التراث وهي أصل المقابل الفرنسي alcool، والإنكليزي alcohol.
أطلق قديماً في الغرب على الحد الأول من الأغوال CH3 – OH اسم الكربينول وانتمت إليه الأسماء الأخرى المعروفة. ويعطى لكل فرد من الأغوال اسم الجذر المرتبط بزمرة الهدروكسيل مسبوقاً بكلمة غول. ويسمى كل غول منهجياً باسم الفحم الهدروجيني الموافق RH بعد وسمه بالنهاية النوعية ول:غول الميتيل (الميتانول، الكربينول). [[غول البنزيل (فينيل الميتانول أو فينيل الكربينول) C6H5CH2OH. عندما تحتوي سلسلة الغول على ثلاث ذرات من الكربون أو أكثر فإن ظاهرة التماكب (التصاوغ) تستدعي منهجياً تمييز كل متماكـب isomer موضعي بـرقم الـذرة الحاملة لزمرة الهدروكسيل، مثال ذلك: البروبانول - 1(غـول نظامي البروبـيل) CH3 – CH2 – CH2– OH، والبروبانول -2 (غـول إيـزو البروبيل): CH3 – CHOH – CH3. البنتـانول -1 CH3 – CH2 – CH2 – CH2 – CH2OH. و2 ،2 - ثنائي ميتيل الإيتانول (غـول ثالثي البوتيل) (CH3)3C – OH البوتن]] -3- ول -1 CH2 = CH – CH2 – CH2 – OH.
أتواع الأغوال
تصنف الأغـوال في كونها أولية (CH2OH-)، وثانوية (>CHOH)، وثالثية (->COH). والصيغة العامـة للكحولات الأحاديـة الهدروكسيل OH اللاعطرية CnH2n+1OH عندما يحتوي جزيء مركب على أكثر من وظيفة غولية ألحق بالمركبات ذات الوظائف المتعددة المتجانسة: الديولات مثل CH2OH – CH2OH ويسمى الإتيلين گليكول (أو الإيتان ديول أو ثنائي هدروكسي الإيتان) فهو يحوي زمرتي OH ويستعمل مضاداً للتجمد anti- freeze في الشاحنات والسيارات، والتريولات مثل الگليسرول (البروبان تريول، أو ثلاثي هدروكسي البروبان]]) وهو كحول ثلاثي الهدروكسيل يستخدم في صناعة الأدوية ومواد التجميل. وتنتمي السكاكر(السكريدات) إلى المركبات ذات الوظائف المتعددة غير المتجانسة.
الخواص الفيزيائية
لا يوجد أي غول في الحالة الغازية في درجة الحرارة العادية وتحت الضغط الجوي. والأغوال، بصورة عامة، مركبات خطرة وسامة. تكون الأغوال الأولية (ذات السلاسل الكربونية النظامية الأليفاتية) حتى C12، سوائل لا لون لها، أما الأفراد الأثقل فإنها صلبة. وتراوح قيم الكتلة الحجمية (كثافة) للأغوال المشبعة بين 0.80 و0.85غ/سم3، ولا تتجاوز قرائن انكسارها القيمة 1.42. الأغوال صعبة التبلور فيما عدا الأغوال الثالثية (ينصهر غول ثالثي البوتيل عند الدرجة 25 ْس). للأغوال نقاط غليان أعلى من درجات غليان الألكانات الموافقة، والأغوال أقل تطايراً، وأكثر ذوباناً في الماء.
يبين الجدول (1)، أن إحلال زمرة OH- محل هدروجين فحم هدروجيني يرافقه ارتفاع كبير في درجة الغليان يتجاوز التناسب المتوقع من ازدياد الوزن الجزيئي، وأكبر من الارتفاع الذي تسببه جميع المتبادلات الأخرى OCH3، CHO (الميتان، الميتانول، إيتر الميتيل، الإيتانال) بما فيها الثقيلة منها Cl,Br,I (الإيتانول، وهالوجينات الإيتيل). تبين مقارنة درجتي غليان الميتانول والإيتان، ودرجتي غليان الإيتانول والبروبان (ذات الأوزان الجزيئية المتقاربة) أن درجات الغليان لا تتعلق بازدياد ثقل الجزيء. ويلاحظ أن فرق درجة غليان كل حد من السلسلة النظامية ثابت ويساوي 19 ْس كلما أضيف CH2 إلى السلسلة. ولا يلاحظ هذا الفرق في سلسلة الألكان الموافقة RH. يتطلب تفسير اختلاف درجتي غليان المتماكبين الوظيفيين للصيغة الجزيئية C2H6O، الإيتانول (+78.3 ْس)، وايتر الميتيل (-24 ْس)، يتطلب هذا دراسة بنية روابط كل جزيء، وإمكانية الزمرة O – H تشكيل روابط هدروجينية ما بين جزيئية.
المركب
درجة الغليان، سْ
المركب
درجة الغليان، سْ
CH3
-161.5
CH3 - OH
+64.7
CH3 - CH3
-88.5
CH3 - CH2OH
+78.3
CH3CH2CH3
-42.2
CH3 - CH2 CH2OH
+97.2
CH3 - F
-142
CH3 - CH2 - Cl
+13.1
CH3 - O -CH3
-24
CH3 - CH2 - Br
+38.4
CH3 - CHO
-2.08
CH3 - CH2 - I
+72.3
الجدول (1) درجات غليان بعض الأغوال بالمقارنة مع المركبات الأخرى
تعود خاصة ارتفاع درجة غليان الأغوال إلى الروابط الهدروجينية التي تتشكل بين جزيئات الغول نتيجة استقطاب الرابطة O – H وتولد شحنة جزئية سالبة (−δ) على أكسجين الزمرة الهدروكسيلية وشحنة جزئية موجبة (+δ)على هدروجينها. والرابطة الهدروجينية ضعيفة إذ يكفي إضافة المركب إلى مذيب مناسب حتى تنفصم جزيئاته وتتبعثر في المذيب.
إن حدود الأغوال اللاعطرية الأحادية الهدروكسيل الأولى، الميتانول CH3OH والإيتانول C2H5OH والبروبانول - 1 C3H7OH، ذوّابة في الماء بشتى النسب، ويعود الفضل في ذلك إلى الروابط الهدروجينية المختلطة المتشكلة بين الزمر الهدروكسيلية في جزيئات الغول وجزيئات الماء. ويغلي أبسط الديولات (الإيتان ديول) عند الدرجة 197 ْس، ويعزى إلى هذه الدرجة المرتفعة، إضافة لانخفاض درجة تجمده وقابليته الشديدة للذوبان في الماء، سبب استعماله مضاداً للتجمد.
يلاحظ بارتفاع الوزن الجزيئي للغول نقصان قابليته للذوبان في الماء بسبب ازدياد أهمية الجزء الفحمي الهدروجيني للجزيء بالنسبة إلى المجموعة الوظيفية، فمقدار ما يذوب في لتر من الماء من كل من البوتانول - 1 (C4)، والبنتانول -1 (C5)، والهكسانول -1 (C6)، والهبتانول -1 (C7) مقدراً بالغرام، هو على التوالي: 80، 22، 7، 3. تذوِّب الأغوال [[القلويات، واليود (محلول بني)، وضروب النتريت (النتريتات) القلوية، ويوديد البوتاسيوم KI، والمركبات العضوية الأكسجينية غير الذوابة في الفحوم الهدروجينية (ثنائيات الحموض، هدروكسي الحموض، السكريدات). لا تذوب ضروب الكبريتات والفوسفات والكربونات القلوية في الأغوال.
الخواص الكيمياوية
تعود الخواص الكيمياوية للوظيفة الغولية إلى استقطاب الرابطتين C – O ،O – H، ووجود ثنائيتين إلكترونيتين حرتين على ذرة الأكسجين، وإلى الرابطة كربون هدروجين H – COH في الأغوال الأولية والثانوية. تقوم الأغوال بثلاثة نماذج من التفاعلات، يحصل الأول نتيجة انفصام الرابطة O – H. ويحدث الثاني في مستوى الرابطة C – OH. أما النمط الثالث فهو تفاعل أكسدة.
تضفي قطبية الرابطة O – H على الهدروجين الوظيفي بعض قابلية الحركة أو الانزلاق. ولا يوافق ذلك في الأغوال صفة حمضية حقيقية. إن تأين الأغوال في المحاليل المائية، وانفصام الرابطة O – H معدوم عملياً، فثابت التفكك (K) يتراوح بين 10-16 و10-19. وقد اتضح من نتائج الدراسات أن الأغوال الأولية أضعف حموضة بمائتي مرة من حموضة الماء. يلاحظ الانفصام O – H في الوسط القلوي مثل أميد الصوديوم NaNH2 ومع المعادن الشديدة الكهرجابية مثل Na، وتتناقص فعاليته، من الأغوال الأولية إلى الثانوية فالثالثية. يكوّن التفاعل أيون الألوكسيد .RO-
تتفاعل الأغوال مع الحموض العضوية الكربوكسيلية[ر. الحموض الكربوكسيلية] معطية الإستر الموافق. يخرج جزيء الماء من هدروكسيل الحمض، وهدروجين الغول. وتفاعل الأسترة بطيء وعكوس تحفزه H+، ويطلق مصطلح الحلمهة (التحلل بالماء) hydrolysis على تفاعله العكسي:
لا تتغير تراكيز المكونات الأربعةعند التوازن بمرور الزمن نتيجة تساوي سرعتي التفاعل في كلا الاتجاهين.
لا يحدث انفصام الرابطة C – O في الأغوال تلقائياً، ويتطلب تحفيزاً حمضياً ببرتنة الأكسجين، لجعله أكثر قطبية وتسهيل خروج OH الغول. تعطي الأغوال مع الحموض الهالوجينية H – Br) HX أو (H – Cl هالوجينات الألكيل. يتشكل مثلاً 1- بروم البروبان من غول نظامي البروبيل. و2- كلور البوتان من غول ثانوي البوتيل.
يتخلى الغول في هذه التفاعلات عن الزمرة OH خلافاً لتفاعله مع الحمض الكربوكسيلي، وتنعكس فعالية أصناف الأغوال الثلاثة، فتفاعل الأغوال الثالثية أسرع وأكمل، وخاصة عند استعمال HI. تنتج R – X أيضاً من تفاعل الأغوال مع مركبات مثل خماسي كلوريد الفسفور PCl5، أو كلوريد الثيونيل SOCl2. ويستعمل مع الأغوال الأولية PCl5 الذي يفصم الرابطتين R – OH وRO – H. ومع الثالثية كلوريد الحمض.
وتعطي الأغوال الأولية الأمينات بتفاعلها مع النشادر بوجود حفّاز (وسيط) من الألومين عند الدرجة 350 ْس:
السمية Toxicity
كيمياء الكحول
طرق التحضير Preparation
طرق مخبرية Laboratory
هناك ثلاث طرق عامة لتحضير الكحول :
- من هاليدات الألكيل : تتفاعل هاليدات الألكيل مع NaOH المائي أو KOH لتعطي بشكل أساسي كحولا أولية .
- R-Br + KOH → R-OH + KBr
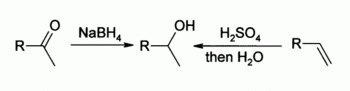
- من الألدهيدات و الكيتونات : يتم ارجاع هذه المركبات باستخدام بوروهيدريد الصوديوم أو ليتيوم ألمنيوم هيدريد :
- R-CHO - [O] → R-OH
- من الألكينات : تفاعل هدرجة محفّز حمضيا acid catalysed باستخدام حمض الكبريت المكثف كوسيط ( تعطي هذه الطريقة كحولا ثانوية و ثالثية بشكل رئيسي )
- C2H4 + H2SO4 (l) → C2H5-HSO4
- C2H5-HSO4 + H2O → C2H5OH + H2SO4
يمكن تحضير الكحول الثانوية باستخدام الطريقتين الأخيرتين كما يلي :
طرق صناعية Industrial
- C12H22O11 → C6H12O6 + C6H12O6
- Invertase → glucose + fructose
- C6H12O6 + H2O → C2H5OH + CO2
- Glucose → zymase + ethanol
- إماهة hydration : باستخدام الايتن أو ألكينات اخرى مأخوذة من اجزاء من الزيت المقطر . و باستعمال محفز من حمض الفوسفور تحت ضغط و درجة حرارة عالية .
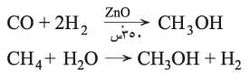
- ميتانول من بخار الماء : عملية اصطناع غازية يحدث فيها دمج لجزيء CO مع جزيئين H2 لإنتاج الميتانول باستخدام النحاس كمحفز ، ZnO و Al2O3 كمحفزات عند درجة حرارة 250°C و ضغط 50يساوي -100 ضغط جوي .
- [CO + H2] + H2O (g) → CH3OH
التفاعلات
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
نزع البروتون Deprotonation
يمكن للكحول أن تسلك سلوك الحموض الضعيفة فتخضع لتفاعل نزع البروتون منتجة ملح الكوكسيد و ذلك إما باستخدام هيدريد صوديوم أو ن-بوتيل الليتيوم أو باستخدام أحد معدنين : الصوديوم أو البوتاسيوم .
- 2 R-OH + 2Na → 2R-O−Na+
- مثلا 2 CH3CH2-OH + 2 Na → 2 CH3-CH2-O−Na+
الماء مشابه للعديد من الكحول في درجة pKa لهم ، لذلك فإن التوازن الكيميائي في تفاعل الكحول مع القلويات مثل هيدروكسيد الصوديوم ييل دوما نحو اليسار :
- R-OH + NaOH <=> R-O-Na+ + H2O (equilibrium to the left)
تفاعلات التبادل المحبة للنواة
لا تعتبر مجموعة الهيدروكسيل مجموعة مغادرة جيدة في تفاعلات التبادل المحبة للنواة ، لذا فإن الكحول المعتدلة لا تشارك في هذه التفاعلات . لكن اذا حصلت برتنة للأكسجين الكحولي أولا لنحصل على R−OH2+, ، عندئذ يكون لدينا مجموعة مغادرة ممتازة هي جزيئة الماء لكونها أكثر ثباتا ترموديناميا عندما تكون مستقلة و يحدث عندئذ تقاعل التبادل المحب للنواة .
الكحول الثالثية تتفاعل مباشرة مع حمض كلور الماء لإنتاج هاليدات ألكيل ثالثية ، حيث يتم استبدال زمرة الهيدروكسيل بذرة كلور .
أما الكحول الثنائية و الأولية فهي بحاجة لمنشط عند تفاعلها مع حمض كلور الماء ، أهم هذه المنشطات التفاعلية هي كلوريد الزنك أو يمكن احداث التحول مباشرة باستخدام كلوريد التيونيل
يمكن أيضا تحويل الكحول إلى بروميدات اللكيل باستخدام حمض بروم الماء أو ثلاثي بروميد الفوسفور .
- 3 R-OH + PBr3 → 3 RBr + H3PO3
بلمهة تفاعلات نزع الماء الأغوال
الكحول بحد ذاتها محبة للنواة ، لذا فإن R−OH2+ يمكن ان يتفاعل مع ROH لإنتاج ايترات و ماء . التفاعل يخضع بشكل عام لقاعدة زايتسيف ، التي تقول أن الألكين الأكثر ثباتا ( و هو عادة الألكين الأكثر تبادلية ) هو الذي يتشكل . تختلف درجة سهولة هذا التفاعل حسب رتبة الغوال فالكحول الثالثية تخسر الماء في درجات حرارة أعلى من درجة حرارة الغرفة بقليل ، في حين تحتاج الغوال الولية درجات حرارة أعلى بكثير .
المخطط التالي يبين تفاعل نزع الماء من ايتانول متحولا إلى ايتن :
تتبلمه الأغوال بطريقتين:
أ ـ تفاعل جزيئي داخلي (حذف الهدروكسيل وذرة هدروجين من كربون مجاور، وإنتاج الألكن alkene الموافق).
ب ـ تفاعل ما بين جزيئي (حذف جزيء الماء من الزمرتين الوظيفيتين لجزيئين من الغول والحصول على الإتير المتناظر).
تلعب شروط التفاعل دوراً في توجيه التفاعل وتحديد الناتج (المنتج). تيسر درجة الحرارة المتوسطة تشكل الإتير، حين يسخن الغول بوجود حمض الكبريت أو حمض الفسفور أو حمض الحماض. أما تمرير أبخرة الغول على الألومين (الدرجة 350 ْ-400 ْس) فيعطي الألكن بشكل رئيسي. وتزداد سهولة البلمهة من الأغوال الأولية إلى الثالثية، إذ تتبلمه هذه الأخيرة بمنتهى السهولة، بمجرد التسخين أحياناً.
يعد تفاعل البلمهة الداخلية للأغوال، الأولية والثانوية أحادية الزمرة OH، من تفاعلات الحذف المعاكسة لتفاعلات الضم إلى الألكنات. وتكون بلمهة الأغوال الثانوية أسهل نسبياً من بلمهة الأغوال الأولية المتماكبة (المتصاوغة). ولا تتم هذه البلمهة في الأغوال الثالثية:
ينتج البوتن -1 من بلمهة البوتانول-1 (CH3 – CH2 – CH2 – CH2OH). ويعطي كل من البروبانول -1، والبروبانول -2 غاز البروبن]]. ويحضر البنتن -2 من البنتانول - 3، وحلقي البنتن من حلقي البنتانول. أما البلمهة الداخلية للهكسانول -2 فتعطي الهكسن -2 فقط. وقد أكدت التجارب الأخرى على مركبات مماثلة أن هدروجين الماء، في تفاعلات البلمهة، يخرج من ذرة الكربون الأقل هدروجيناً والمجاورة لذرة الكربون التي تحمل زمرة الهدروكسيل.
الأسترة
- R-OH + R'-COOH <=> R'-COOR + H2O
الأكسدة
3 CH3-CH(-OH)-CH3 + K2Cr2O7 + 4 H2SO4 → 3 CH3-C(=O)-CH3 + Cr2(SO4)3 + K2SO4 + 7 H2O
تحتوي الأغوال الأولية والثانوية على ذرات هدروجين مرتبطة بذرة كربون مرتبطة الزمرة الهدروكسيلية. ولهذا تعاني الرابطة C – H تفاعل الأكسدة الملاحظ في الألدهيدات. وتفاعل الأكسدة مهم لأنه يولد المركبات الكربونيلية الموافقة. تتحول الأغوال الأولية بالأكسدة المدبرة (الخاضعة للتحكم) إلى ألدهيدات، ويمكن لهذه الألدهيدات أن تتحول بدورها إلى حموض كربوكسيلية لكونها هي نفسها شديدة القابلية للتأكسد. وإذا أنجز التفاعل عند درجة حرارة أعلى من درجة غليان الألدهيد فإن الألدهيد يتبخر عند تشكله دون أن يعاني من الأكسدة الأبعد مدى. تتحول الأغوال الثانوية إلى كيتونات، الحد النهائي للتفاعل، إلا إذا كانت شروط الأكسدة شديدة. لا تتأكسد الأغوال الثالثية، في الشروط المدبرة أكسدة مباشرة، وتفقد، بسبب سهولة بلمهتها، جزيئاً من الماء، في وسط حمضي، ويتكوّن ألكن يمكنه أن يتأكسد بالطريقة النظامية. ويستعمل في أكسدة الأغوال الأولية والثانوية عد د من المؤكسدات مثل: Na2Cr2O7, CrO3, KMnO4.
الأكسدة المباشرة للأغوال بالأكسجين
لعل أسهل طرائق أكسدة الكحولات هي حرقها. فالإيتانول، على سبيل المثال، يحترق وشعلته ذات لون أزرق شاحب. إلا أنه يمكن استعمال طرائق أقل عنفاً، فتتحول الكحولات الأولية إلى ألدهيدات وحموض كربوكسيلية. والأغوال الثانوية إلى كيتونات. أما الأغوال الثالثية فلا تتفاعل في هذه الشروط. وبتسخين محلول كحول إيتيلي في محلول حمضي لثنائي كرومات الصوديوم ذات اللون النارنجي، مع توخي الحذر، يتحول اللون إلى الأخضر نظراً لإرجاع الكروم (VI) إلى الكروم (III) ذي اللون الأخضر وتأكسد الكحول.
يعطي الإيتانول الإيتانال وحمض الإيتانويك (الخل)، ويعطي البروبانول-2 البروبانون(الأسيتون).
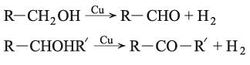
نزع الهدروجين من الأغوال - الأكسدة الحفزية (الوساطية)
تتحول الأغوال الأولية إلى ألدهيدات والثانوية إلى كيتونات بتفاعل نزع الهدروجين. يشبه هذا التفاعل تفاعل الأكسدة إذ ينطلق هدروجين من الزمرة الوظيفية الغولية – CH2OH عند تمرير أبخرة الغول، فوق حفّاز من مسحوق النحاس، عند الدرجة 300 ْ س تقريباً والتفاعل ماص للحرارة.
لا تتخلى الأغوال الثالثية عن الهدروجين، وتتبلمه في هذه الشروط، بصورة عامة، إلى ألكينات. وتكمن فائدة الأكسدة الحفزية (الوساطية) في الحصول على ناتج من الألدهيدات الصرفة دون أن تحتوي على منتج ثانوي من الحموض الكربوكسيلية الموافقة التي تتشكل معها بطرائق الأكسدة الأخرى.
استعمالات الأغوال
للأغوال أهمية اقتصادية وتطبيقية كبيرة، فهي تستعمل مطهرات ومذيبات وكواشف اصطناع ومواد أولية، وتعد مصدراً رئيساً مولداً لمواد أولية أخرى أو لمنتجات صناعية هامة إذ تبدأ منها المراحل الأولى للاصطناع الكيمياوي. يمكن عملياً تحويلها إلى أي مركب أليفاتي، كما أنها تشكل مدخلاً لكيمياء المركبات الأكسجينية الأخرى ذات الوظائف الوحيدة، أو المتعددة، المتجانسة منها وغير المتجانسة.
مصادر الأغوال وطرق استحصالها
توجد بعض الأغوال في الحالة الطبيعية في بعض الخلاصات النباتية، وغالباً ما تكون على شكل إستيرات. فعطر الخزامى (اللاوندة lavender)، هو 3 ،7 - ثنائي ميتيل الأوكتانول - 3. علماً أن متماكبيه في الموقعين 1 أو 2 لا رائحة لهما. يشكل الغليسرول الجزء الغولي من الإستيرات المكوِّنة للمواد الدهنية. وتعد هدرات الكربون carbohydrates أحد المصادر الرئيسة للحصول على الإيتانول وبعض الأغوال الأخرى بالتخمر الغولي. وتُنتَج الأغوال صناعياً ومخبرياً بالاصطناع الكيمياوي:
1 ـ من التفاعلات المفيدة للحصول على الأغوال مخبرياً، تفاعل حلمهة هالوجينات الألكيل RX بالتسخين مع القلوي
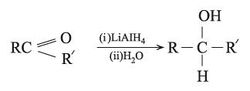
2 ـ من هدرجة المشتقات الكربونيلية (الألدهيدات أو الكيتونات) وساطياً بوجود Ni حفّازاً. أو هدريد الليتيوم والألمنيوم، AlLiH4: تنتج الأغوال الأولية من هدرجة الألدهيدات، والثانوية من هدرجة الكيتونات.
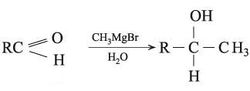
ـ من تفاعل كاشف غرينيار RMgX مع CO2، ومع الألدهيدات أو الكيتونات أو الإستيرات. فالألدهيدات تعطي كحولات ثانوية، وتعطي الكيتونات كحولات ثالثية:
3 ـ من إماهة hydration الألكنات بوجود حمض الكبريت. فيتم تفاعل إضافة مثال ذلك:
4 ـ تؤدي حلمهة الإستير ′R – CO – OR إلى غول وحمض كربوكسيلي. ويطلق على التفاعل، اسم تفاعل تصبن، عند استعمال الصود، إذ ينتج الملح الصوديومي للحمض الكربوكسيلي، وهو الصابون المعروف عندما تكون R كبيرة. تعطي الهدرجة المباشرة للإستيرات غولَين. وينتج الغليسرول من حلمهة أو تصبن الإستيرات الطبيعية للدهون والشحوم. ويتم الحصول على الأغوال العليا الأولية المستعملة بخاصة في صناعة المنظفات بهدرجة الألدهيدات الناتجة من «[[اصطناع أكسو».
من أكثر الكحولات شيوعاً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
غول الميتيل (الميتانول) CH3OH
أبسط الأغوال، والحد الأول من الأغوال الأولية. يستعمل في صناعة المواد البلاستيكية مباشرة، أو بعد تحويله بالأكسدة (عند الدرجة 200 ْس) إلى الميتانال HCHO، ويدخل في صناعة المضافات الأكسجينية لمختلف الوقود. وأضيفت نسبة منه في أوربا في نهاية القرن العشرين إلى وقود السيارات بسبب ارتفاع سعر النفط بعد حرب تشرين عام 1973. والميتانول مركب سائل طيار سام، يؤدي امتصاص الكائنات الحية له إلى أخطار جسيمة. ويصعب على العضوية الحية طرحه والتخلص منه. يحذّر من أبخرته إذ لا يجوز أن يتجاوز حجم بخاره في الهواء 200 جزء بالمليون. ويسبب شربه أو تنفسه مدة طويلة أو تركه ملامساً للجلد إلى العمى أو الموت. تبلغ جرعته المميتة 30 مل، أما الجرعات الأقل فتسبب عمى مزمناً.
تعد الهدرجة الحفزية لأحادي أكسيد الكربون، عند درجة حرارة نحو 350 ْس، تحت ضغط مرتفع بوجود كروميت أو أكسيد الزنك، الطريقة الصناعية الفضلى للحصول على الميتانول. يتم الحصول على كل من الهدروجين وCO من تفاعل الماء وفحم الكوك أو من أكسدة الميتان أو فحم هدروجيني أعلى بدرجات عالية من الحرارة.
غول الإيتيل، أو الإيتانول C2H5OH
من أقدم المركبات العضوية وأكثرها أهمية من الناحيتين التطبيقية والصناعية. فهو مادة أولية في الاصطناع الكيمياوي. ويدخل في أركان الصناعة الكيمياوية المختلفة. يستعمل مذيباً للكيمياويات الصيدلانية والصناعية (مثل مواد الطلاء، والورنيش، والعطور، والمنكهات). ويدخل في صناعة الأدوية، ومستحضرات التجميل، وصناعة المشروبات الروحية (الكحولية)، وفي عمليات التنقية بالبلوَرة. ويستعمل وسطاً للتفاعلات الكيمياوية. ومن مشتقاته ثنائي إيتيل الإتير C2H5 – O – C2H5، وخلات الإيتيل CH3 – COOC2H5، والإتيلين CH2 = CH2، وإيتوكسيد الصوديوم Na – O – C2H5 الذي يستعمل أساساً في التفاعلات، وفي تحضير الإتيرات المتناظرة أو المختلطة. ويُسمح لوقود السيارات، في أوربا، أن تحوي 5% من الإيتانول. وهو يحترق أو يتأكسد وفق المعادلات التالية:
وتفاعل الاحتراق (1) أكثرها نشراً للحرارة (325.7 حريرة)، بينما ينشر تفاعلا الأكسدة الثاني 49.4 والثالث 118. يحضر الإيتانول بطريقتين:
أ ـ الاصطناع الكيمياوي، ب ـ تخمر هدرات الكربون carbohydrates.
أ - الاصطناع الكيمياوي لغول الإيتيل (الإيتانول)
1- من الأسيتيلين C2H2 الناتج من الفحم(عبر كربيد الكلسيوم CaC2). يعالج الأستيلين بوسط حمضي بوجود حفّـاز من ملح الزئبق معطياً أولاً الأسيت ألدهيد CH3 – CHO الذي يُختَزل (فوق النيكل) إلى إيتانول. وهذه الطريقة، قليلة الاستعمال بسبب كلفتها العالية بعد توفر الإتلين بكثرة من تكسير البترول.
2 - من تفاعل ضم الماء إلى الإتلين بوساطة حمضية من H2SO4 (إماهة غير مباشرة للإتلين). أما الإماهة المباشرة فتتم عند ضغط مرتفع وبوجود حفّاز من الألومين.
ب - صناعة الغول من هيدرات الكربون - التخمر
تعود معرفة الإنسان لعملية تخمر fermentation السكاكر والنشويات، وإنتاجها للغول، إلى ما قبل التاريخ prehistoric. وبذلت على مر العصور جهودٌ، وأنجزت دراسات متعددة، حول التخمر الغولي ومراحله، وتحفيزه، ورفع مردوده، ومنتجاته الثانوية، ومصادره الأولية التي باستطاعتها التحول إلى مواد قابلة للتخمر فأصبحت شاملةً لمختلف منتجات هدرات الكربون الطبيعية Cn(H2O)n من أحاديات ومتعددات السكاريد saccharide، والنشا، والسلولوز.
ويعد التخمر الطريقة التقليدية في تحضير الإيتانول من عصير الفواكـه بفعل الأنزيمات على السكاكـر، لاسيما الفركتوز والغلوكوز اللذين لهما الصيغة نفسها C6(H2O)6، بفعل الأنزيمات، وأحد هذه الأنزيمات ذلك الذي يوجد في الخميرة وهو الزيماز zymase وهو فعَّال في إحداث التخمر. وفي صناعة النبيذ تكون الأعناب مصدر السكاكر والخميرة ويزداد مقدار السكر داخل العنب مع ازدياد النضج وتبدأ الخميرة بالنمو على السطح الخارجي للثمار، فيمتزج العصير السكري والخميرة سوية عند هرس الأعناب ويبدأ التخمر. أما سكر القصب C12H22O11 وهو سكر عصي على الأنزيم الزيماز، فيحوَّل إلى جلوكوز وفركتوز بأنزيم آخر هو الأنفرتاز:
وينبغي إجراء التخمير في زجاجة محكمة الإغلاق إذ يتحرر ثنائي أكسيد الكربون CO2 في أثناء التخمر مزيحاً بسرعة الهواء من الزجاجة، وبالتالي يجري التخمر في شروط لاهوائية ويمكن تمثيل التفاعل الذي يجري بالمعادلة:
تفاعل محفَّز بالزيماز
ويتثبط فعل الزيماز، ويتوقف التفاعل عندما تبلغ نسبة الكحول 14% ولا يجوز أن يدخل الهواء إلى المزيج، إذ إن الأكسجين يؤكسد الكحول فيحوله إلى حمض الإيتانويك (الاسم القديم لحمض الخل) الذي يعطي الخل مذاقه الحمضي ويتسبب وجوده في تخريب المشروب الكحولي. ويقطر الناتج لزيادة نسبة الكحول فوق 14%. وتختلف نسبة الكحول في منتجات التقطير باختلاف عدد المرات التي تكرر فيها عملية التقطير.
يعتمد المذاق الذي تتصف به أنواعُ النبيذ والمشروبات الكحولية على عدة أمور، وبخاصة على المزيج المعين من الكحولات والإسترات المعقدة التي تتكون أثناء عملية التخمر وأثناء الفترة التي يترك فيها السائل الكحولي حتى ينضج. فعندما يحفظ النبيذ والكحولات في براميل خشبية، فإن الخشب نفسه يكسبها مذاقاً.
جـ ـ التخمر الصناعي
من المعروف منذ باستور Pasteur أن 100كغ من السكروز sucrose، وهو سكر المائدة المعروف، وهو من ثنائيات السكاريد، يعطي 105.26كغ من السكر المنقلب وتنتج 51.11كغ من الإيتانول (64.33 لتراً)، و49.32كغ من CO2، و3.16كغ من الغليسرول ومركبات ثانوية أخرى. ويعد المردود الصناعي مرضياً إذا نتج 62 لتراً من الإيتانول انطلاقاً من 100كغ من السكر.
تستغرق عملية التخمير للحصول على c منتج كحولي نحو 20 إلى 30 ساعة بين درجتي الحرارة 30 ْ - 35 ْس. تخفض درجة الحرارة لجعل عملية التخمر أبطأ وتحسين المردود والحصول على مواصفات مختلفة. وينبغي خلال عملية التخمر تحاشي الحصول على مركبات ثانوية غير مرغوبة مثل مشتقات اللبن lactic من خلال مراقبة عملية التخمر، في أوعية من الخشب أو الإسمنت أو الحديد، ودرجة الحرارة، وpH الوسط، والخمائر وغذائها.
استهلاك الإيتانول
يشكل الإيتانول غول المشروبات الروحية (الكحولية) الناتجة من تخمر تشكيلة سكاكر مختلفة المصادر النباتية. ولكل مشروب مادته المخمِّرة، وشروط تخمره (انطلاق أو عدم انطلاق ثنائي أكسيد الكربون)، وعبوات التعبئة، والعمليات اللاحقة للتخمر (تقطير، بدون تقطير). لا علاقة للإيتانول بنكهة أو بمذاق المشروب، النوعية التي تتعلق بمواد أخرى تميز خصوصية المصدر، أو بمواد مضافة تضاف عن قصد. تتعلق نسبة الإيتانول في المشروب على عملية التخمر ومادتها. تعد فواكه الأجاص، والتفاح والكرز، والخوخ والعنب من المصادر الرئيسة للخمور. ويمكن لمولاس قصب السكر وقصب السكر نفسه أن يعطيا عرق قصب السكر (الروم) rhum. ويستعمل الشيل rye المخلوط بحبوب أخرى في صناعة الويسكي. وباستعمال منتش الشعير malt الذي يحتوي خميرة الدياستاز diastase يتم تحويل النشاء إلى غلوكوز قابل للتخمر في عملية مفيدة لصناعة الجعة.
يخزن معظم الإيتانول ويستعمل عادة بتركيز 95%، لأن الإيتانول المصنع يكون ممزوجاً بالماء، ويركز بالتقطير. ويتم الحصول على الغول الصرف أو المطلق (100%)، بتقطير الإيتانول 95% بوجود مادة شرهة للماء مثل الجليسرين أو الأملاح (مثل كلوريد الكلسيوم أو كبريتات المغنزيوم). وللحصول على الإيتانول الجاف، يعالج الإيتانول مع المغنزيوم فيتكوّن Mg(OH)2 الراسب ثم يقطر الناتج.
الإيتانول من الأغوال الأولية. كتلته الجزيئية 46.07. وعرفت صيغته عام 1827، وحضر من مصادر أولية غير طبيعية (غير التخمر) منذ عام 1854. وهو سائل لا لون له، يغلي في الدرجة 78.3 ْ س تحت الضغط الجوي، ولا رائحة له عملياً في حالته الصرفة، قرينة انكساره 1.361 عند الدرجة 20.5 ْس. ودرجة انصهاره -112 ْس. وحرارته النوعية 0.615 عند الدرجة 20.5 ْس. وقدرته الحرورية 5300 حريرة/لتر (6042 حريرة/كغ). والإيتانول أقل حموضة بأربع مرات من الماء. يذيب العديد من المواد العضوية واللاعضوية. ويمتزج مع الماء بشتى النسب، ويصاحب هذا المزج انتشار حرارة، ونقص في الحجم يصل إلى 4%. يصنف الإيتانول طبياً مادة منومة، وهو أقل سمية نسبياً من الأغوال الأخرى. إن نتائج فعله في العضوية الحية وتأثيره الشديد على الجملة العصبية المركزية معروفة تماماً وبخاصة عند ارتفاع نسب جرعاته المتناولة وإدمانه. يؤدي قليل من الغول في الإنسان إلى حالة شعور بالنشاط والخفة (أي الزهزهة) euphoria. وتؤدي كميات أكبر منه إلى خمود (ضعف) الجملة العصبية المركزية.
يميز بين الإيتانول المستعمل للمشروبات الروحية (الكحولية) والمستعمل في الصناعة، إذ يشوه الأخير بإضافة مادة مشوِّهة denaturant أو أكثر لجعله ساماً أو غير مستساغ. ويوجد لهذا الغرض أكثر من 80 مـادة من بينها وقود السيارات (الغازولين) والميتانول. فعلى سبيل المثال يضاف 3.34% وزناً مـن الميتانـول، و0.96% من البروبانول -2. تستعمل الدول المنتجة للإيتانول طريقة لتشويهه بحسب قوانينها النافذة، وتشرف على إنتاجه ومصيره جهة متخصصة.
الإيتانول والطاقة والتوازن البيئي
يستمد الإنسان حالياً وقود مواصلاته،عملياً، من مخزون الوقود الموجود في البترول (النفط) بصورة مباشرة أو غير مباشرة. والبترول محدود الكمية وتتفاقم مشاكله الاستراتيجية بتقدم الزمن، ويصرف نسبة مرتفعة منه في وقود المواصلات، بدلاً من حفظه لحاجة الصناعة الكيمياوية المتزايدة. ينتج عن الاستعمال المتزايد للوقود الأحفوري زيادة مستمرة في كمية ثنائي أكسيد الكربون CO2، وارتفاع مستمر لدرجة حرارة الأرض.
يمكن للإيتانول، أن يستعمل وقوداً في وسائل النقل بديلاً عن الجازولين (البنزين) دون حاجة لتبديل مستودعات الوقود الحالية وخزاناته في محطات التوزيع ووسائل النقل. ومن ميزات مصادره السلولوزية، من الخشب والحشائش، كونها غير محدودة، وغير مستنفذة باطراد، ومتجددة وتعوض باستمرار، وتلبي حاجة البشرية من وقود وسائل النقل. إن احتراق الإيتانول هو التفاعل المعاكس لإنتاج الجلوكوز من أكسيد الكربون والماء بالطاقة الشمسية بوجود اليخضور. وتؤمن كمية CO2 المحفوظة التوازن الطبيعي بين العملية الضوئية واستهلاك الإيتانول وقوداً.[1]