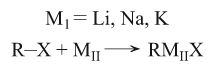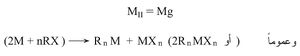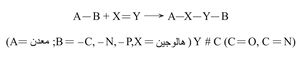كيمياء فلزية عضوية

الكيمياء العضوية الفلزية إنگليزية: Organometallic chemistry هو علم دراسة المركبات الكيميائية التي تحتوي روابط بين كربون وفلز. [1][2] بما أن الكثير من المركبات التي لا تحوي مثل هذه الروابط تكون متشابهة كيميائياً، يمكن بالتالي تحديد المركبات التي يدرسها هذا العلم بأنها الحاوية على روابط فلز-عنصر ذات الصفة التساهمية الكبيرة.
تأخذ الكيمياء العضوية الفلزية خصائص من الكيمياء العضوية واللاعضوية.
المركب العضوي المعدني مادة تكون فيها رابطة واحدة على الأقل بين معدن وكربون موجود في زمرة عضوية مثل رباعي إيتيل الرصاص Pb(C2H5)4، وهي المادة التي تضاف إلى بنزين السيارات مضادة للدق، والفيروسين Fe(C5H5)2 تكون فيه ذرة الحديد محصورة بين زمرتي C5H5 مثل السندويش. وعُرفت بعض المركبات العضوية المعدنية منذ بداية القرن العشرين أو قبل ذلك مثل ألكيلات الزنك، والزئبق والزرنيخ، ولكن تطور هذا العلم - وخاصة المركبات العضوية للعناصر الانتقالية - يعد حديثاً.
المركبات الفلزية العضوية تمر بعدة تفاعلات هامة:
- oxidative addition and reductive elimination
- transmetalation
- carbometalation
- Hydrometalation
- electron transfer
- beta-hydride elimination
- organometallic substitution reaction
- carbon-hydrogen bond activation
- cyclometalation
- Migratory insertion
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
أسهمت دراسة المركبات العضوية المعدنية في تقديم معلومات نظرية وعمليـة إلى الكيميـاء، فالبحث في تحضير ودراسة خواص يوديد إتيل الزنك وثنائي إتيل الزنك قادت الإنكليزي فرانكلاند Frankland عام 1853 ليعرض أول كشف حول نظرية التكافؤ في المركبات العضوية المعدنية، حيث اقترح أن كل معدن يملك استطاعة اتحادية محددة.[3]
فتح اصطناع الفيروسـين (π–C5H5)2Fe عام 1951 وتفسير بنيته الفراغية في العام التالي مجالاً من البحث غير المتوقع أسهم إسهاماً كبيراً في فهم طبيعة الرابطة C–M. ومن وجهة النظر العملية، أسهم اكتشاف المركبات العضوية لهاليدات المغنزيوم (كواشف غرينيار Grignard reagents التي صيغتها RMgX) في اصطناع مركبات عضوية وأخرى عضوية معدنية مختلفة. ومن التطبيقات الصناعية تم اصطناع هاليدات السيليكون العضوية التي تعد مواد وسطية في صناعة بوليميرات السيليكون. وأخيراً فإن اصطناع هاليدات الألمنيوم الألكيلية قاد إلى استخدامها في كثير من تفاعلات الوساطة بالتبلمر المتعدد.
خط زمني للكيمياء الفلزية العضوية
- 1760 Louis Claude Cadet de Gassicourt investigates inks based on كوبالت salts and isolates Cacodyl from cobalt mineral containing arsenic
- 1827 Zeise's salt is the first platinum / olefin complex
- 1863 Charles Friedel and James Crafts prepare organochlorosilanes
- 1890 Ludwig Mond discovers Nickel carbonyl
- 1899 Introduction of Grignard reaction
- 1900 پول ساباتييه works on hydrogenation organic compounds with metal catalysts. Hydrogenation of fats kicks off advances in food industry, see margarine
- 1909 پول إرليخ introduces Salvarsan for the treatment of syphilis, an early arsenic based organometallic compound
- 1912 Nobel Prize ڤيكتور گرينيار وپول ساباتييه
- 1930 Henry Gilman works on lithium cuprates, see Gilman reagent
- 1951 Ferrocene is discovered
- 1963 Nobel prize for Karl Ziegler and جوليو ناتا on Ziegler-Natta catalyst
- 1965 Discovery of cyclobutadieneiron tricarbonyl
- 1968 Heck reaction
- 1973 Nobel prize Geoffrey Wilkinson and Ernst Otto Fischer on sandwich compounds
- 2005 Nobel prize Yves Chauvin, Robert Grubbs, and Richard Schrock on metal-catalyzed alkene metathesis
الخواص الفيزيائية والكيميائية
صُنِّفت معظم المركبات العضوية المعدنية على أنها مركبات عضوية وليست لاعضوية. وبسبب كون جزيئاتها غير مترابطة فإن درجات انصهارها وغليانها أخفض مما يتوقع بالمقارنة مع بلورات شبيهة، حيث توجد في الدرجة العادية من الحرارة على شكل سائل أو غاز (Me3B). وعموماً تنحل المركبات العضوية المعدنية في المحلات العضوية المنخفضة القطبية مثل التولوين والإيترات والأغوال.
تختلف خواصها الكيميائية بعضها عن بعضها الآخر اختلافاً واسعاً. فمثلاً يعد مركب تترا متيل سيلان Me4Si ثابتاً عند درجة الحرارة العالية (500 ْس) في حين يتفكك تترا إتيل الليثيوم Et4Li بسرعة عند درجة حرارة الغرفة. وعلى نحو مشابه فإن هنالك اختلافاً كبيراً عند دراسة الثبات الحركي لتفاعلات الأكسدة فبعضها مثل Me2Hg وMe4Si لا يتأثر بأكسجين الهواء عند درجة حرارة الغرفة، في حين يحترق بعضها تلقائياً في جو الغرفة مثل Me3B , Me2Zn.
تُصنف المركبات العضوية المعدنية تبعاً لطبيعة الرابطة C–M التي تحويها. ويعد الكربون عنصراً كهرسلبياً (2.5 على سلم باولي)، لذلك يتوقع أن يُشكل روابط مختلفة حسب كهرجابية العناصر المرتبطة مع الكربون:
رابطة أيونية
وتتشكل مع العناصر الشديدة الكهرجابية ويكون تشكل هذه المركبات الأيونية ممكناً خاصة عند ثبات الشـاردة العضويـة السالبة بوساطة الرنين الذي يؤدي إلى لا تموضع الشحنة وتوزعها على ذرات الكربون في الحلقة العطرية أو على الجزء الحاوي على روابط متعددة
رابطة تساهمية (مشتركة)
وتتشكل في أنواع من الروابط مثل B–C في Me3B وSi–C في Me4Si وMg–C في كواشف غرينيار RMgX.
تساهمية منقوصة الالكترونات (الروابط المتعددة المركز)
تشكل العناصر Al, Mg, Be, Li مركبات جسرية عبر المرتبطات الألكيلية والأريلية. إن تشكل هذا النوع من المركبات معروف كما في هدريدات البور B2H6، ولكن وجد حديثاً أنها ممكنة التشكل في مركبات من النوع Me4Li4 و(Me2Be)n و(Me3Al)2 مع معادن مداراتها التكافؤية نصف مملوءة.
روابط متشكلة في المعقدات العضوية للعناصر الانتقالية
على الرغم من أن المجموعة d- للعناصر الانتقالية تشبه العناصر الرئيسية بقدرتها على تشكيل روابط M–C لكن العناصر الانتقالية تتميز بخاصة تشكيلها معقدات مع الفحوم الهدروجينية غير المشبعة. إن قدرة العناصر الانتقـالية على تشـكيل روابط π- يترافق بمساهمة الإلكترونات للمدارات d- التي لها طاقة من رتبة الروابط التساهمية المصادفة.
ثبات المركبات العضوية المعدنية
عند مناقشة ثبات مركب ما فإنه يجب تحديد نوعية الثبات، فكلمة ثبات يمكن أن ترمز إلى الثبات الحراري أو إلى المقاومة للتفاعلات الكيميائية وخاصة الأكسدة أو الإماهة.
الثبات الحراري thermal stability
تعد حرارة تشكل المركبات قياساً لثباتها الترموديناميكي، وانخفاض طاقة تشكل المركبات التي تحوي زمر المتيل لعناصر الدور القصير الأول مثل Me3N وMe4C دليل على قوة الارتباط بين المرتبطات والعنصر. تكون المركبات العضوية المعدنية مثل Me4S وMe3B صعبة التفكك إلى عناصرها المكونة في حين تكون مركبات عناصر الدور الطويل الثالث Me4Pb وMe3Tl وMe2Hg غير ثابتة وتتفكك إلى مكوناتها وتوصف بأنها ماصة للحرارة وغير ثابتة ترموديناميكياً .
الثبات تجاه الأكسدة
تعد المركبات العضوية المعدنية غير ثابتة تجاه تفاعلات الأكسدة بسبب الربح الكبير في الطاقة الحرة الناتج من تشكل أكسيد المعدن وثنائي أكسيد الكربون والماء. تتأكسد جميع المركبات المتيلية المعدنية بسهولة لكن Me2Hg ومشتقات عناصر الفصيلة IV B في الجدول الدوري تكون خاملة. هنالك مركبات أخرى مثل Me2Zn وMe3In وMe3Sb تحترق تلقائياً في الهواء. ويترافق عدم الثبات الحركي بالنسبة لتفاعلات الأكسدة بوجود مدارات تحت سطحية فارغة مثلاً 5P في Me3In أو بوجود زوج إلكتروني غير رابط كما في حالة Me3Sb .
الثبات تجاه الحلمهة (التحلل بالماء) hydrolysis
يحصل تفاعل الحلمهة عند توفر مدار تحت سطحي فارغ في ذرة المعدن M، وتعتمد سرعته على قطبية الرابطة M–C؛ وعندما تكون هذه القطبية شديدة كما في Me3Al تهاجم بسرعة من قبل الماء في حين Me3B لا يتأثر بالماء عند الدرجة العادية من الحرارة، علماً بأن ذرة البور تحوي مدارات p2P فارغة، كذلك فإن المركبات المعدنية العضوية التي تحوي مرتبطات معتدلة تكون خاملة تجاه تفاعلات الحلمهة.
استحضار المركبات المعدنية العضوية
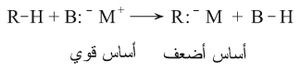
أ ـ تفاعلات الأسس القوية مع الفحوم الهدروجينية
مثال:
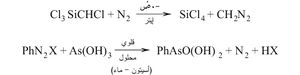
ب ـ تفاعل المعدن مع هاليد عضوي:
أمثلة :
حيث M1 هو أحد عناصر الفصيلة IA (أو 1)
حيث MII هو أحد عناصر الفصيلة II (أو 2)
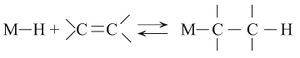
جـ ـ تفاعل أولفين أو أسيتيلين مع هدريد معدن:
د ـ تشكل الروابط كربون - معدن بوساطة تفاعلات إضافة أخرى:
تعد إضافة هدريدات المعادن إلى الروابط الثنائية والثلاثية كربون - كربون حالة خاصة من طريقة تفاعل عام يتضمن إضافة جزيئات من الشكل A–B إلى رابطة غير مشبعة X = Y أو (X ≡Y )
هـ ـ تفاعلات مركبات دي آزو:
يمكن إسهام مركبات دي آزو الأليفاتية والعطرية في تشكل الروابط كربون - معدن
أمثلة:
و ـ نزع زمر الكربوكسيل من أملاح المعادن الثقيلة:
- مثال
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الفلزيات العضوية
- Period 2 elements: organolithium chemistry, organoberyllium chemistry, organoborane chemistry,
- Period 3 elements: organomagnesium chemistry, organoaluminum chemistry, organosilicon chemistry
- Period 4 elements: organotitanium chemistry, organochromium chemistry, organomanganese chemistry organoiron chemistry, organocobalt chemistry organonickel chemistry, organocopper chemistry, organozinc chemistry, organogallium chemistry, organogermanium chemistry
- Period 5 elements: organopalladium chemistry, organosilver chemistry, organocadmium chemistry, organoindium chemistry, organotin chemistry
- Period 6 elements: organoiridium chemistry, organoplatinum chemistry, organogold chemistry, organomercury chemistry, organothallium chemistry, organolead chemistry
انظر أيضاً
مراجع
- ^ Robert H. Crabtree (2005). The Organometallic Chemistry of the Transition Metals. Wiley. p. 560. ISBN 978-0-471-66256-3.
- ^ Toreki, R. (2003-11-20). "Organometallics Defined". Interactive Learning Paradigms Incorporated.
- ^ أسامة ضبيط. "المركبات العضوية المعدنية". الموسوعة العربية. Retrieved 2012-09-01.
مراجع للاستزادة
- وفائي حقي، صلاح يحياوي، نذير لداوي، يحيى القدسي، الكيمياء العضوية العامة والوظائف البسيطة (المطبعة الجديدة، دمشق 1981-1982).
- G.E.COATES, M.L.H. GREEN, P. POWELL and K. WADE , Principles of Organometallic Chemistry (Chapman and Hall 1977).
- T.W.G.SOLOMONS , Organic Chemistry ( John Wiley 2000).