عنصر كيميائي
العناصر الكيميائية Chemical element، هي مجموعة جزئية من المواد في الطبيعة ، تتكون من ذرات من مادة واحدة وتوجد اما بشكل طبيعي في الارض او يقوم الانسان بتكوينها ، وجد منها حتى عام 2004 116 عنصر ، 91 منهم موجود في الطبيعة بشكل طبيعي ويقوم العلماء بتصنيفها على اسس كتلها الذرية وصفاتها الكيميائية ، من اشهر التصنيفات واوسعها انتشارا الجدول الدوري لماندليف ، تقابلها المركبات الكيميائية التي تتكون من مجموعات من الذرات من العناصر المختلفة مترابطة معا لتكوين شكل جديد من المادة بخصائص جديدة ، واي مادة موجودة هي اما عنصر من هذه العناصر او مركب مكوّن من هذه العناصر ، وذلك باستثناء الجسيمات الدون ذرية.[1]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوصف
تتحد العناصر بعضها مع بعض بنسب متنوعة مكوِّنة مواد أعقد. يتحد الهدروجين H2 مع الأكسجين O2 ويكوِّنان الماء H2O، ويتحد الحديد مع الأكسجين مكوناً الصدأ. والمركب compound هو أي مادة تتألف من عنصرين أو أكثر اتحدا مع بعضهما بنسبة ثابتة. مثال ذلك الماء، مهما كان مصدره، يكون العنصران فيه متحديْن بنسبة غرام واحد من الهدروجين إلى ثمانية غرامات من الأكسجين. والماء الأكسجيني صيغته H2O2 مركب آخر ينتج من اتحاد الهدروجين والأكسجين؛ لكن هذين العنصرين يتحدان في هذا المركب بنسبة ثابتة تختلف عن تلك التي في الماء؛ فغرام واحد من الهدروجين يتحد مع 16غرام من الأكسجين لتشكيل الماء الأكسجيني.
العدد الذري
تبين بنتيجة التحليل الكيميائي أن غراماً واحداً من الحديد يتحد مع 0.574غ من الكبريت. وبما أن نسبة عدد ذرات الحديد إلى عدد ذرات الكبريت تساوي 1/1، فهذا يعني أن ذرات الحديد في هذا المركب أثقل بـ 1.000/0.574=1.742مرة. وكتلة ذرة الحديد تساوي 1.742 كتلة ذرة الكبريت. وهكذا، عندما يتحد أي وزن من الحديد مع وزن من الكبريت أصغر منه بـ 1.742 مرة، فمن المؤكد أن نسبة عدد ذرات الحديد إلى عدد ذرات الكبريت تساوي 1 إلى واحد. فسواء اتحد 1.742غ حديد مع 1.000غ كبريت، أو 2.000غ حديد مع 1.148غ كبريت، أو 3.484غ حديد مع 2.000غ كبريت، فنسبة وزن الحديد إلى الكبريت 1.000/0.574=1.742/1.000=2.000/1.1148=3.484/2.000=1.742.
الكتلة الذرية والوزن الذري
قدّم دالتون نظريته المتعلقة ببنية المادة عام 1803، فأسهمت نظريته هذه في إجراء مزيد من الأبحاث لإيجاد الكتل النسبية لذرات العناصر. فكان لهذه الأبحاث أثر بالغ الأهمية في مستقبل الكيمياء وفي حقول المعرفة المتعلقة بها كافة؛ للحاجة إلى طريقة عملية لوزن عيّنات العناصر التي تحوي ذرات العناصر بالنسب اللازمة لاصطناع المركبات. فإذا كان المطلوب، على سبيل المثال ، كمية من مركب كبريت الحديد، FeS ,(II)، فذرات الحديد في هذا المركب تتحد مع ذرات الكبريت بنسبة 1 إلى 1. فكل ذرة من الحديد تتحد مع ذرة واحدة من الكبريت. وعملياً، تكمن الصعوبة في أن الذرات صغيرة جداً بحيث لايمكن عدّها كما تعدّ الأشياء الكبيرة. وإن النسبة ذرة واحدة إلى ذرة واحدة هي النسبة المهمة بغض النظر عن وزن ذرة الحديد أو وزن ذرة الكبريت.
فكل ما يلزم من أجل تعيين الأوزان الذرية هو انتخاب عنصر يعد أساساً لمقارنة أوزان باقي العناصر بالنسبة إليه. وهذا الانتخاب اختياري. فيمكن على سبيل المثال، استعمال الكبريت لهذا الغرض. وتم الاتفاق، عالمياً على اتخاذ نظير الكربون 21 أي عدده الكتلي 12 المرجع العياري. وبهذا الاختيار يكون الوزن النسبي لأخف العناصر جميعاً، الهدروجين، مساوياً 1 تقريباً.
وإن الكتلة الوسطية لذرات العنصر الموجودة في الطبيعة مقاسة بالنسبة إلى المرجع الكربون 12 تدعى الوزن الذري للعنصر.
وبإجراء قياسات غير مباشرة تبيّن أن كتلة ذرة واحدة من الكربون 12 تساوي 1.9926786×10-23 غراماً. وإن 1/12 من هذه الكتلة يدعى واحدة الكتلة الذرية (اختصاراً و.ك. ذ)؛ أي:
و. ك. ذ = 1.6605665×10-24 غرام
وتسمح هذه الكمية باستعمال واحدة الكتل الذرية واحدةً لقياس الأوزان الذرية. فعلى سبيل المثال الوزن الذري لنظير الكربون 12 يساوي تماماً 12 و.ك. ذ.
وإن الاستنتاج الرئيسي من دراسة الأوزان الذرية هو أنه إذا أخذت عينتان من أي عنصرين بحيث تكون نسبة وزنيهما (بالغرام) مساوية إلى نسبة وزنيهما الذريين، فتكون نسبة عدد ذرات أحد العنصرين إلى عدد ذرات الآخر تساوي 1/1. وإذا كان المطلوب نسبة بين عدد ذرات الأول إلى الثاني مختلفة عن الواحد، فيمكن تعديل أمثال نسبة الوزن الذري للأول إلى الوزن الذري للثاني.
أما في المركبات الكيميائية، فيدعى مجموع الأوزان الذرية للذرات الموجودة في الصيغة الكيميائية وزن صيغة المركب، ويسمى أيضاً الوزن الجزيئي. وإن «وزن صيغة المركب» أشمل من «الوزن الجزيئي»؛ لأنه يمكن استعمال المصطلح الأول في حالة المركبات أو العناصر، بغض النظر عن أنواع الجسيمات المكوِّنة له. فيمكن القول إن وزن صيغة الصوديوم هو 22.98977، وهو يساوي الوزن الذري في الوقت ذاته. وإن وزناً من المادة يساوي الوزن الجزيئي مقدراً بالغرام يدعى الوزن الجزيئي الغرامي أو المول.
وعدد وحدات الصيغة في المول كبير جداً يصعب تخيله، فالمول الواحد من المادة النقية يحوي 6.02×2310 وحدة صيغة ويدعى هذا العدد عدد أفوغدرو[ر]. وهو يدل على مدى صغر الذرات والجزيئات. وتأتي أهمية عدد أفوغدرو من أن العدد نفسه من المولات يحوي العدد نفسه من وحدات الصيغة. فـ 10.5 مول من السكر، على سبيل المثال، تحوي عدداً من وحدات الصيغة (جزيئات) مساوياً 10.5 مول من الحديد (وحدات صيغته هي الذرات).
لمفهوم المول أهمية كبيرة ؛لأنه يساعد على التفكير بالصيغ على مستويين في الوقت نفسه، مستوى ذرة/جزيء من جهة ومستوى الكميات العملية المستعملة من المختبر من جهة أخرى، فاثنا عشر جزيئاً من H2O تحوي 2×12 ذرة من الهدروجين واثني عشر جزيئاً من الأكسجين O. وإن الأعداد هي نفسها سواء في حالة الجزيئات والذرات أو في حالة المولات.
النظائر
النظائر isotopes هي ذرات لعنصر واحد، ولكن الفرق بينها هو الاختلاف في عدد النترونات في كل منها، فللأكسجين النظير 16 والنظير 17 والنظير 18 ، وجميعها لها العدد الذري 8.
التآصل
الخصائص
الحصائص العامة
States of matter
الذوبان ونقطة الغليان
تبلغ درجة الانصهار أدنى حد لها في الغازات النادرة، وتبلغ أعلى حد لها في الفصيلة IVA (أو 14) بالنسبة للعناصر الخفيفة، وفي الفصيلة VIB (أو 6) بالنسبة للعناصر الثقيلة. ومما يلاحظ أيضاً أن عناصر الفصيلة الواحدة تشغل مواضع متشابهة على الأجزاء الصاعدة أو الهابطة من المنحني.
ومن المفيد القول إن ارتفاع درجة حرارة انصهار الكربون (د. أ > 3500 ْس) يعود إلى قوة الرابطة المشتركة بين ذراته، كما يعود الانخفاض المفاجئ في درجة انصهار الآزوت (-120 ْس) عن العنصر الذي قبله وهو الكربون إلى ضعف الروابط التي تربط جزيئات N2 فيما بينها.
=الكثافات
تتغير كثافة العناصر وهي في حالتها الصلبة بصورة دورية مع أعدادها الذرية. تزداد الكثافة من عنصر إلى الذي يليه في الدور الواحد بصورة منتظمة، فتبلغ أعلى قيمة لها في وسط الدور، كما أنها، بصورة عامة، تزداد في الفصيلة الواحدة من الأعلى إلى الأسفل.
التركيب البلوري
يعد نصف قطر الذرة أو الشاردة (الأيون)، عادة، المسافة بين النواة والطبقة الخارجية للإلكترونات. ومن الواضح أنه يستحيل عزل ذرة أو شاردة بمفردها لتعيين نصف قطرها، خاصة أن حجمها أو نصف قطرها يتأثر بتجمعها مع جسيمات أخرى. فقيمة نصف القطر في المركّب تتوقَّف على العوامل الآتية: نوعية الرابطة شاردية كانت أو معدنية أو مشتركة، وهل هي أحادية أم مضاعفة أو ثلاثية، وهي تتوقف أيضاً على عدد أكسدة الذرة، وعلى العدد التساندي للذرة؛ أي عدد الذرات المرتبطة مباشرة بالذرة في البلورة وعلى قوى التدافع بين الذرات غير المرتبطة مباشرة معها بعضها مع بعض.
نصف القطر الذري يتناقص من اليسار إلى اليمين بالدور الواحد، ويعزى التناقص في الحجم إلى ازدياد العدد الذري للعناصر. فعندما يزداد العدد الذري تزداد شحنة النواة ويزداد جذبها للإلكترونات، وهذا يؤدي إلى نقصان حجم الذرة. ولهذا النقصان في الحجم تأثير في الخواص المعدنية للذرات. فكلما كبر حجم الذرة بعدت إلكترونات التكافؤ عن النواة وأصبحت إمكانية الذرة في التخلي عن هذه الإلكترونات أكبر، أي ازدادت الصفة المعدنية للذرة. يمكن أيضاً القول إنه إذا كان لذرتين الحجم الذري نفسه، كانت الذرة ذات العدد الذري الأكبر (شحنة نواتها أكبر) أكثر لامعدنية، وبتعبير آخر اللامعادن هي العناصر ذات الذرات الصغيرة والشحنات الكبيرة.
التواجد والأصل على الأرض
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
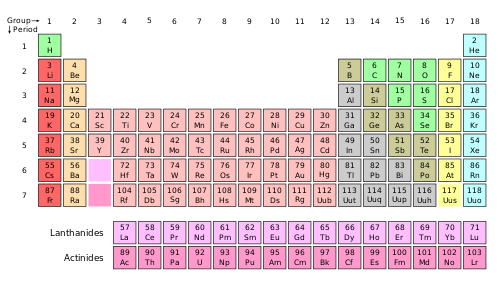
الجدول الدوري
| المجموعة | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الهيدروجين والفلزات القلوية |
الفلزات الأرضية القلوية | Pnictogens | Chalcogens | Halogens | Noble gases | ||||||||||||||
| الدورة |
|||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 1 (أحمر)=غاز | 3 (أسود)=صلب | 80 (أخضر)=سائل | 109 (رمادي)=غير معروفة | لون الرقم الذري يبين حالة المادة (عند 0 °س و 1 atm) |
| بدائي | من اضمحلال | اصطناعي | الإطار يبين التوافر الطبيعي للعنصر |
- Ca: 40.078 — Abridged value (uncertainty omitted here)[3]
- Po: [209] — mass number of the most stable isotope
| s-block | p-block | d-block | f-block | لون الخلفية يبين مستوى فرعي بالجدول الدوري |
إن صفات العناصر تابع دوري لأعدادها الذرية، والدورية تعني أن بعض الصفات المميزة تعيد نفسها بعد مرور فترات محددة. فبترتيب العناصر حسب تزايد أعدادها الذرية تظهر الدورية ليس فقط في خواص العناصر الكيميائية، بل في خواصها الفيزيائية وبنيتها الإلكترونية أيضاً.
إن الصفتين البنيويتين اللتين تحددان الخواص الكيميائية للعناصر هما حجم الذرات أو الشوارد وسهولة إزاحة الإلكترونات.
تتناقص الصفة المعدنية بالانتقال في الجدول الدوري من اليسار إلى اليمين بينما تزداد الصفة اللامعدنية. إن تناقص أنصاف أقطار العناصر في الدور الواحد من اليسار إلى اليمين يجعلها تحتفظ بالإلكترونات بصورة أكبر. ويلاحظ، بصورة عامة، أن ذرات العناصر المعدنية كبيرة بينما ذرات العناصر اللامعدنية صغيرة. ويستنتج من ذلك أن أقوى العناصر المرجعة هي المعادن؛ لأنها تتخلى عن إلكتروناتها بسهولة مشكلة شوارد موجبة تشكل بدورها ماءات.
تزداد الصفة المعدنية للعناصر بالانتقال في الفصيلة الواحدة من الأعلى إلى الأسفل، فيعدّ الآزوت مثلاً، الواقع في أعلى الفصيلة الخامسة، لا معدناً، بينما يعد البزموت الواقع في أسفل الفصيلة نفسها معدناً. ويعبر عن ذلك بصورة أخرى: إن أكثر العناصر المشكلة للحموض تقع في أعلى الفصائل في الجدول الدوري، بينما تقع أكثر العناصر المشكلة للأسس في أسفل هذا الجدول. فماءات الفسفور حمضية التفاعل، بينما ماءات البزموت أساسية التفاعل.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التسمية والرموز
سبقت تسمية العناصر النظرية الذرية للمادة، بالرغم انه في ذلك الوقت لم يعرف أي المواد كانت عناصر وأيها مركبات. ولما عرف البشر ان المادة تتكون من ذرات العناصر، تم الإبقاء على الأسماء المعروفة كالذهب والزئبق والنحاس والحديد في أغلب بلدان العالم.وظهرت أسماء محلية للعناصر ، إما للتسهيل او لضروريات لغوية ، او لأسباب قومية. فعلى سبيل المثال يطلق الفرنسيون على النيترجين إسمه القديم ولكن التاريخي ، الآزوت.
الأرقام الذرية
مجموع عدد البروتونات والنترونات يساوي العدد الكتلي mass number الذي يرمز له بالحرف A. فالأكسجين، على سبيل المثال، تحوي نواته ثمانية بروتونات، فعدده الذري Z يساوي 8. أما عدد النترونات فقد يختلف من ذرة إلى أخرى للعنصر الواحد.
رتبت العناصر بادئ الأمر ضمن جدول وفق تزايد أوزانها الذرية، مما أدى إلى ظهور دورية في خواص العناصر.
كمون التشرد (التأين)
يعرف كمون التشرد ionization potential أنه الطاقة اللازمة لإزاحة أضعف الإلكترونات ارتباطاً من ذرة معزولة لعنصر وهو في الحالة الغازية وفي حالة دنيا من الطاقة من مكانه في الذرة إلى اللانهاية. وتقاس هذه الطاقة بدقة لا بأس بها طيفياً أو بطرق أخرى.
يطلق على كمون التشرد هذا، اسم كمون التشرد الأول، ومن الممكن إزاحة إلكترون ثان من الشاردة الموجبة، إلا أن ذلك يتطلب طاقة أكبر بكثير من السابق. يطلق على هذه الطاقة اسم كمون التشرد الثاني، وبالمشابهة يعرّف كمون التشرد الثالث وكمون التشرد الرابع وهكذا..
إن قيمة كمون التشرد الثالث وما بعده في الذرة كبيرة جداً، ولهذا تكون الشوارد الثابتة هي الشوارد الأحادية أو الثنائية. وأما الشوارد الباقية فلا تكون ثابتة إلا في مركباتها البلورية، وأما في المحاليل فتكون متحدة مع جزيئات المادة المحلة.
تقدر قيم كمونات التشرد بأي وحدة من وحدات الطاقة ( الجول أو الإلكترون فلط أو الحريرة).
الكهرسلبية
هي قياس تجريبي لميل الذرة لجذب الإلكترونات في الجزيء المعتدل . فهي ستختلف حتماً باختلاف درجة أكسدة الذرة. وقد اقترحت طرق عدة لحساب الكهرسلبية، ومن هذه الطرق طريقة بولينغ.
أسماء العناصر
لا تعرّف كتلة العنصر هويته، إلا أنها ذات أهمية كبيرة. يتميز العنصر الكيميائي بعدده الذري Z. يوجد في الطبيعة تسعون عنصراً (من 1= Z إلى 92 =Z) باستثناء العنصرين 23 = Z التكنسيوم Tc و61 =Z البروميثيوم Pm إذ يُصطنعان اصطناعاً بتفاعلات نووية. كما تصطنع بالطريقة نفسها (أي بتفاعلات نووية) جميع العناصر بدءاً من النبتونيوم 93 =Z إلى العنصر الأخير في الجدول الدوري وعدده الذري 118 =Z . ويطلق على هذه الأخيرة اسم عناصر ما بعد اليورانيوم.
الرموز الكيميائية
نواة الذرة مؤلفة من نترونات معتدلة كهربائياً يرمز لعددها عادة بالحرف N وبروتونات ذات شحنة موجبة (شحنة البروتون تساوي شحنة الإلكترون (-e) وتعاكسها بالإشارة). ويرمز لعدد البروتونات عادة بالحرف Z، ويطلق عليه اسم العدد الذري وهو يساوي عدد الإلكترونات في ذرة العنصر.
العناصر الكيميائية المحددة
الرموز الكيميائية العامة
رموز النظائر
أصل العناصر
وفرة العناصر
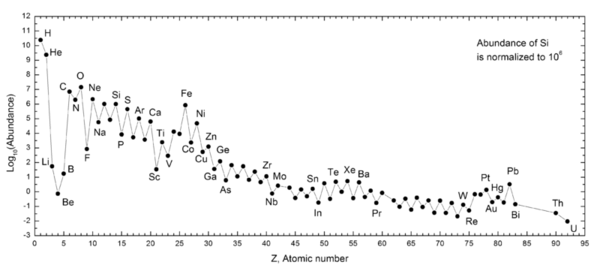
| Elements in our galaxy | Parts per million by mass |
|---|---|
| هيدروجين | 739,000 |
| هيليوم | 240,000 |
| أكسجين | 10,400 |
| كربون | 4,600 |
| نيون | 1,340 |
| حديد | 1,090 |
| نتروجين | 960 |
| سيليكون | 650 |
| مغنسيوم | 580 |
| Sulfur | 440 |
| بوتاسيوم | 210 |
| نيكل | 100 |
قالب:Periodic table (dietary elements)
تاريخ
تطور التعريفات
تغير مفهوم العنصر الكيميائي، على مرّ العصور، بتغير المفاهيم الكيميائية نفسها. وعدَّت النار أول عنصر معروف. وقد اعتقد الفلاسفة الإغريق بوجود أربعة عناصر أساسية هي الماء والهواء والتراب والنار.
استند اليونانيون في تعريفهم هذا إلى النواحي الفلسفية والنظرية دون الاعتماد على التجربة والبرهان، إلى أن جاءت الحضارة العربية والإسلامية التي قادت العلماء إلى تحليل أفكار اليونانيين وإخضاعها إلى التجربة مع إدخال الكثير من التعديلات عليها.
الإكتشاف والتعرف على العناصر المختلفة
دخلت هذه المعارف والمفاهيم أوروبا إبان الفتح العربي الإسلامي وتطورت في القرون الوسطى وعصر النهضة. لكن الكيمياء لم تعرف ازدهاراً مماثلاً لما عرفته علوم الفلك والميكانيك والضوء، وبقيت فناً تجريبياً يقتصر على المشعوذين الذين انشغلوا بالحصول على حجر الفلاسفة وأسرار الحياة، مما أخرّ علم الكيمياء.
عناصر كيميائية مكتشفة حديثا
ومع التقدم الذي بدأ في القرن السابع عشر الميلادي، وعلى الصعيد النظري، اختفى المفهوم الإغريقي للعناصر الأربعة وحل مكانه المفهوم الذري.
وتعاقبت القوانين الناظمة للتفاعلات الكيميائية ، ولتطبيق هذه القوانين قبل الباحثون بأن المادة منقطعة، وتتألف من دقائق متناهية في الصغر وغير قابلة للتجزئة وتتحرك بصورة مستمرة تدعى الذرات، وأن ذرات كل عنصر متشابهة ومتساوية الوزن وتختلف عن ذرات العناصر الأخرى. وينتج من اتحاد ذرات عنصر مع ذرات عنصر آخر ما يدعى بالذرات المركّبة أو ما يعرف حالياً بالجزيئات molecules، وهذه الجزيئات متماثلة في كل نوع كيميائي. كما أن اتحاد الذرات من النوع ذاته يشكل جزيئات الأجسام البسيطة، في حين تتشكل جزيئات الأجسام المركبة من اتحاد ذرات الأنواع المختلفة. وكان لزاماً استخدام الترميز للعناصر بوضع رمز لكل عنصر يدل عليه.
أحدثت التجارب المختلفة التي تمت في الفترة 1875ـ 1910 ثورة في مجال الكيمياء والفيزياء؛ إذ برهنت على أن الذرة ليست المكوّن النهائي للمادة، بل هي نفسها تتألف من أنواع مختلفة من الدقائق.
قائمة من 118 عناصر كيميائية معروفة
| Atomic no. |
Name | الرمز الكيميائي | المجموعة | المدة | Block | State at STP |
التواجد | الوصف |
|---|---|---|---|---|---|---|---|---|
| 1 | هيدروجين | H | 1 | 1 | s | Gas | Primordial | Non-metal |
| 2 | هيليوم | He | 18 | 1 | s | Gas | Primordial | Noble gas |
| 3 | ليثيوم | Li | 1 | 2 | s | Solid | Primordial | Alkali metal |
| 4 | بريليوم | Be | 2 | 2 | s | Solid | Primordial | Alkaline earth metal |
| 5 | Boron | B | 13 | 2 | p | Solid | Primordial | Metalloid |
| 6 | كربون | C | 14 | 2 | p | Solid | Primordial | Non-metal |
| 7 | نتروجين | N | 15 | 2 | p | Gas | Primordial | Non-metal |
| 8 | أكسجين | O | 16 | 2 | p | Gas | Primordial | Non-metal |
| 9 | Fluorine | F | 17 | 2 | p | Gas | Primordial | Halogen |
| 10 | نيون | Ne | 18 | 2 | p | Gas | Primordial | Noble gas |
| 11 | صوديوم | Na | 1 | 3 | s | Solid | Primordial | Alkali metal |
| 12 | مغنسيوم | Mg | 2 | 3 | s | Solid | Primordial | Alkaline earth metal |
| 13 | ألمنيوم | Al | 13 | 3 | p | Solid | Primordial | Metal |
| 14 | سيليكون | Si | 14 | 3 | p | Solid | Primordial | Metalloid |
| 15 | فسفور | P | 15 | 3 | p | Solid | Primordial | Non-metal |
| 16 | Sulfur | S | 16 | 3 | p | Solid | Primordial | Non-metal |
| 17 | كلور | Cl | 17 | 3 | p | Gas | Primordial | Halogen |
| 18 | Argon | Ar | 18 | 3 | p | Gas | Primordial | Noble gas |
| 19 | بوتاسيوم | K | 1 | 4 | s | Solid | Primordial | Alkali metal |
| 20 | كالسيوم | Ca | 2 | 4 | s | Solid | Primordial | Alkaline earth metal |
| 21 | Scandium | Sc | 3 | 4 | d | Solid | Primordial | Transition metal |
| 22 | تيتانيوم | Ti | 4 | 4 | d | Solid | Primordial | Transition metal |
| 23 | Vanadium | V | 5 | 4 | d | Solid | Primordial | Transition metal |
| 24 | Chromium | Cr | 6 | 4 | d | Solid | Primordial | Transition metal |
| 25 | منغنيز | Mn | 7 | 4 | d | Solid | Primordial | Transition metal |
| 26 | حديد | Fe | 8 | 4 | d | Solid | Primordial | Transition metal |
| 27 | كوبالت | Co | 9 | 4 | d | Solid | Primordial | Transition metal |
| 28 | نيكل | Ni | 10 | 4 | d | Solid | Primordial | Transition metal |
| 29 | نحاس | Cu | 11 | 4 | d | Solid | Primordial | Transition metal |
| 30 | زنك | Zn | 12 | 4 | d | Solid | Primordial | Transition metal |
| 31 | Gallium | Ga | 13 | 4 | p | Solid | Primordial | Metal |
| 32 | Germanium | Ge | 14 | 4 | p | Solid | Primordial | Metalloid |
| 33 | Arsenic | As | 15 | 4 | p | Solid | Primordial | Metalloid |
| 34 | سلنيوم | Se | 16 | 4 | p | Solid | Primordial | Non-metal |
| 35 | Bromine | Br | 17 | 4 | p | Liquid | Primordial | Halogen |
| 36 | كريپتون | Kr | 18 | 4 | p | Gas | Primordial | Noble gas |
| 37 | Rubidium | Rb | 1 | 5 | s | Solid | Primordial | Alkali metal |
| 38 | سترونشيوم | Sr | 2 | 5 | s | Solid | Primordial | Alkaline earth metal |
| 39 | Yttrium | Y | 3 | 5 | d | Solid | Primordial | Transition metal |
| 40 | زركونيوم | Zr | 4 | 5 | d | Solid | Primordial | Transition metal |
| 41 | نيوبيوم | Nb | 5 | 5 | d | Solid | Primordial | Transition metal |
| 42 | Molybdenum | Mo | 6 | 5 | d | Solid | Primordial | Transition metal |
| 43 | Technetium | Tc | 7 | 5 | d | Solid | Transient | Transition metal |
| 44 | Ruthenium | Ru | 8 | 5 | d | Solid | Primordial | Transition metal |
| 45 | Rhodium | Rh | 9 | 5 | d | Solid | Primordial | Transition metal |
| 46 | Palladium | Pd | 10 | 5 | d | Solid | Primordial | Transition metal |
| 47 | Silver | Ag | 11 | 5 | d | Solid | Primordial | Transition metal |
| 48 | Cadmium | Cd | 12 | 5 | d | Solid | Primordial | Transition metal |
| 49 | Indium | In | 13 | 5 | p | Solid | Primordial | Metal |
| 50 | Tin | Sn | 14 | 5 | p | Solid | Primordial | Metal |
| 51 | Antimony | Sb | 15 | 5 | p | Solid | Primordial | Metalloid |
| 52 | تلوريوم | Te | 16 | 5 | p | Solid | Primordial | Metalloid |
| 53 | يود | I | 17 | 5 | p | Solid | Primordial | Halogen |
| 54 | Xenon | Xe | 18 | 5 | p | Gas | Primordial | Noble gas |
| 55 | Caesium | Cs | 1 | 6 | s | Solid | Primordial | Alkali metal |
| 56 | باريوم | Ba | 2 | 6 | s | Solid | Primordial | Alkaline earth metal |
| 57 | لانثانم | La | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 58 | Cerium | Ce | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 59 | پراسيوديميوم | Pr | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 60 | Neodymium | Nd | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 61 | Promethium | Pm | 3 | 6 | f | Solid | Transient | Lanthanide |
| 62 | Samarium | Sm | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 63 | اوروپيوم | Eu | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 64 | گادولينيوم | Gd | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 65 | Terbium | Tb | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 66 | ديسپروسيوم | Dy | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 67 | Holmium | Ho | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 68 | Erbium | Er | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 69 | Thulium | Tm | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 70 | Ytterbium | Yb | 3 | 6 | f | Solid | Primordial | Lanthanide |
| 71 | لوتيتيوم | Lu | 3 | 6 | d | Solid | Primordial | Lanthanide |
| 72 | Hafnium | Hf | 4 | 6 | d | Solid | Primordial | Transition metal |
| 73 | Tantalum | Ta | 5 | 6 | d | Solid | Primordial | Transition metal |
| 74 | Tungsten | W | 6 | 6 | d | Solid | Primordial | Transition metal |
| 75 | Rhenium | Re | 7 | 6 | d | Solid | Primordial | Transition metal |
| 76 | اوزميوم | Os | 8 | 6 | d | Solid | Primordial | Transition metal |
| 77 | Iridium | Ir | 9 | 6 | d | Solid | Primordial | Transition metal |
| 78 | بلاتينيوم | Pt | 10 | 6 | d | Solid | Primordial | Transition metal |
| 79 | ذهب | Au | 11 | 6 | d | Solid | Primordial | Transition metal |
| 80 | Mercury | Hg | 12 | 6 | d | Liquid | Primordial | Transition metal |
| 81 | Thallium | Tl | 13 | 6 | p | Solid | Primordial | Metal |
| 82 | Lead | Pb | 14 | 6 | p | Solid | Primordial | Metal |
| 83 | Bismuth | Bi | 15 | 6 | p | Solid | Primordial | Metal |
| 84 | Polonium | Po | 16 | 6 | p | Solid | Transient | Metalloid |
| 85 | Astatine | At | 17 | 6 | p | Solid | Transient | Halogen |
| 86 | Radon | Rn | 18 | 6 | p | Gas | Transient | Noble gas |
| 87 | Francium | Fr | 1 | 7 | s | Solid | Transient | Alkali metal |
| 88 | راديوم | Ra | 2 | 7 | s | Solid | Transient | Alkaline earth metal |
| 89 | Actinium | Ac | 3 | 7 | f | Solid | Transient | Actinide |
| 90 | ثوريوم | Th | 3 | 7 | f | Solid | Primordial | Actinide |
| 91 | پروتكتنيوم | Pa | 3 | 7 | f | Solid | Transient | Actinide |
| 92 | يورانيوم | U | 3 | 7 | f | Solid | Primordial | Actinide |
| 93 | Neptunium | Np | 3 | 7 | f | Solid | Transient | Actinide |
| 94 | Plutonium | Pu | 3 | 7 | f | Solid | Primordial | Actinide |
| 95 | Americium | Am | 3 | 7 | f | Solid | Transient | Actinide |
| 96 | كوريوم | Cm | 3 | 7 | f | Solid | Transient | Actinide |
| 97 | Berkelium | Bk | 3 | 7 | f | Solid | Transient | Actinide |
| 98 | Californium | Cf | 3 | 7 | f | Solid | Transient | Actinide |
| 99 | أينشتاينيوم | Es | 3 | 7 | f | Solid | Synthetic | Actinide |
| 100 | فرميوم | Fm | 3 | 7 | f | Solid | Synthetic | Actinide |
| 101 | Mendelevium | Md | 3 | 7 | f | Solid | Synthetic | Actinide |
| 102 | Nobelium | No | 3 | 7 | f | Solid | Synthetic | Actinide |
| 103 | Lawrencium | Lr | 3 | 7 | d | Solid | Synthetic | Actinide |
| 104 | Rutherfordium | Rf | 4 | 7 | d | Synthetic | Transition metal | |
| 105 | Dubnium | Db | 5 | 7 | d | Synthetic | Transition metal | |
| 106 | Seaborgium | Sg | 6 | 7 | d | Synthetic | Transition metal | |
| 107 | Bohrium | Bh | 7 | 7 | d | Synthetic | Transition metal | |
| 108 | Hassium | Hs | 8 | 7 | d | Synthetic | Transition metal | |
| 109 | Meitnerium | Mt | 9 | 7 | d | Synthetic | ||
| 110 | Darmstadtium | Ds | 10 | 7 | d | Synthetic | ||
| 111 | Roentgenium | Rg | 11 | 7 | d | Synthetic | ||
| 112 | كوپرنيكيوم | Cn | 12 | 7 | d | Synthetic | Transition metal | |
| 113 | (Ununtrium) | Uut | 13 | 7 | p | Synthetic | ||
| 114 | Flerovium | Fl | 14 | 7 | p | Synthetic | ||
| 115 | (Ununpentium) | Uup | 15 | 7 | p | Synthetic | ||
| 116 | Livermorium | Lv | 16 | 7 | p | Synthetic | ||
| 117 | (Ununseptium) | Uus | 17 | 7 | p | Synthetic | ||
| 118 | (Ununoctium) | Uuo | 18 | 7 | p | Synthetic |
انظر أيضا
مراجع
[http://www.vanderkrogt.net/elements/ صفحة عن تاريخ العناصر تشمل اسمائها بالعربية
- ^ عبد المجيد البلخي. "العنصر الكيمياوي". الموسوعة العربية. Retrieved 2012-09-01.
- ^ Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (2022-05-04). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry (in الإنجليزية). doi:10.1515/pac-2019-0603. ISSN 1365-3075.
قراءات للإستزادة
- Ball, P (2004). The Elements: A Very Short Introduction. Oxford University Press. ISBN 0-19-284099-1.
- Emsley, J (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 0-19-850340-7.
- Gray, T (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers Inc. ISBN 1-57912-814-9.
- Scerri, ER (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press.
- Strathern, P (2000). Mendeleyev's Dream: The Quest for the Elements. Hamish Hamilton Ltd. ISBN 0-241-14065-X.
- سمير مصطفى المدني، أساسيات الكيمياء العامة (جامعة الملك سعود ـ الرياض 1418هـ).
- P. ARNAUD,Cours de Chimie physique, 3e édition (Dunod 1991).
وصلات خارجية
- Videos for each element by the University of Nottingham