بريليوم
 | |||||||||||||||
| بريليوم | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | أبيض-رمادي لامع | ||||||||||||||
| الوزن الذري العياري Ar°(Be) | |||||||||||||||
| بريليوم في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 4 | ||||||||||||||
| المجموعة | 2 | ||||||||||||||
| الدورة | period 2 | ||||||||||||||
| المستوى الفرعي | s-block | ||||||||||||||
| التوزيع الإلكتروني | [He] 2s2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 2 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 1560 K (1287 °س، 2349 °F) | ||||||||||||||
| نقطة الغليان | 3243 K (2970 °س، 5378 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 1.85 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 1.690 ج/سم³ | ||||||||||||||
| النقطة الحرجة | 5205 K, MPa (تم استقراؤه) | ||||||||||||||
| حرارة الانصهار | 12.2 kJ/mol | ||||||||||||||
| حرارة التبخر | 292 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 16.443 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| حالات الأكسدة | +2, +1[1] | ||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.57 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 112 pm | ||||||||||||||
| نصف قطر التكافؤ | 96±3 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 153 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| التواجد الطبيعي | primordial | ||||||||||||||
| البنية البلورية | hexagonal close-packed (hcp) | ||||||||||||||
| سرعة الصوت قضيب رفيع | 200 W/(m·K) | ||||||||||||||
| التمدد الحراري | 11.3 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 36 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسي معاكس | ||||||||||||||
| معامل يونگ | 287 GPa | ||||||||||||||
| معامل القص | 132 GPa | ||||||||||||||
| معاير الحجم | 130 GPa | ||||||||||||||
| نسبة پواسون | 0.032 | ||||||||||||||
| صلادة موز | 5.5 | ||||||||||||||
| صلادة ڤيكرز | 1670 MPa | ||||||||||||||
| صلادة برينل | 590–1320 MPa | ||||||||||||||
| رقم كاس | 7440-41-7 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف | لويس نيكولاس ڤوكويلين (1797) | ||||||||||||||
| أول عزل | فريديش ڤوهلر وأنطوان بسي (1828) | ||||||||||||||
| نظائر البريليوم | |||||||||||||||
| قالب:جدول نظائر بريليوم غير موجود | |||||||||||||||
البريليوم Beryllium هو عنصر كيميائي يرمز له بالرمز Be وعدده الذري 4 ، وهو عنصر ثنائي التكافؤ وسام ، لونه رمادي قريب للون الفولاذ صلب وخفيف لكنه هش ، وهو فلز قلوي ترابي ، يستخدم بشكل رئيسي في تصليب السبائك كنحاس البريليوم.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
خصائص عامّة
للبريليوم احدى اعلى درجات الانصهار بين الفلزات الخفيفة ، وله معامل مرونة اكبر من معامل مرونة الفولاذ بمقدار الثلث تقريبا ، يتمتع بموصلية حرارية ممتازة ، كما انه لا يتمغنط ويقاوم حمض النيتريك بشكل جيد جدا ، له انفاذية عالية لاشعة اكس (الاشعة السينية او اشعة رونتجن) ، كما ان البريليوم يطلق النيوترونات عند اصطدام جسيمات الفا به ، كتلك المنطلقة من الراديوم او البلوتونيوم (حوالي 30 نيوترون لكل مليون جسيم الفا) ، وفي درجة الحرارة وقياس الضغط القياسيين ، يقاوم البريليوم التأكسد عند تعرضه للهواء (لاحظ ان قدرة البريليوم على خدش الزجاج يعود على الاغلب لوجود طبقة رقيقة جدا من اكسيد البريليوم على السطح).
الخصائص الفيزيائية
تتلخص خاصيات البريليوم الفيزيائية فيما يأتي: إلكترونات التكافؤ الخارجية: 2s2 نصف القطر الذري: 1.12 أنجستروم (10-10 م) نصف القطر الأيوني (الشاردي): 0.31 أنجستروم (10-10م) الكثافة: 1.85غ/سم3 درجة الانصهار: 1278ْس (سلسيوس) درجة الغليان: 2970ْس حرارة التبخر: 77.87 حرة/جزيء غرامي كمون التأيٌّن (التشارد) [بالإلكترون فُلط ev]: الأول 9.32 (ev)، الثاني 18.21 (ev)[4]
تاريخه
اسمي البريليوم بهذا الاسم اشتقاقا من الكلمة اليونانية beryllos, beryl ، وكان قد اسمي لفترة بالگلوسينيوم (من لفظة glykys اليونانية التي تعني حلو)، وذلك لحلاوة طعم املاحه، واكتشف هذا العنصر على يد لوي نيكولا ڤوكلان Louis Nicolas Vauquelin عام 1798 على شكل أكسيد في البريل، وفي الزمرد، واستطاع العالمان فريدريش ڤولر Friedrich Wöhler وأنطوان بوسي Antoine Bussy فصل العنصر بشكل حر، كل على حدة عام 1828 وذلك بتفاعل البوتاسيوم مع كلوريد البريليوم.
توافره
يوجد البريليوم في 30 معدن مختلف ، اهمها البرترانديت ، البريل ، الكريسوبريل والفيناسيت . واشكال ثمينة من البريل هي الزبرجد والزمرد ، وذلك بصهره وتبريده السريع بالماء ثم حلّه في حمض الكبريت الكثيف حيث يتشكل محلول كبريتات البريليوم BeSO4 وكبريتات الألمنيوم Al2(SO4)3 وكبريتات المعادن القلوية.اما المصدر التجاري للبريليوم ومركباته فهو البريل والبرترانديت . ومعظم انتاج هذا الفلز يتم باختزال فلوريد البريليوم مع فلز المغنسيوم .ولم يتوفر البريليوم بشكل سهل حتى عام 1957.
ويستحصل البريليوم بالتحليل الكهربائي لصهارة مزيج الملحين BeCl2 و NaCl في الدرجة 350ْس، حيث يتشكل الكلور على المصعد الغرافيتي والبريليوم على المهبط النيكلي. ويستحصل البريليوم بالإرجاع الحراري لـ BeF2 أو BeCl2 المصهور مع المغنسيوم.
فصله
وبإضافة كبريتات الأمونيوم (NH4)2SO4 ، يُفصل الألمنيوم على شكل ملح شب الأمونيوم NH4Al(SO4)2.12H2O القليل الانحلال، ومن ثَمَّ تتبلور كبريتات البريليوم من المحلول وتتحول إلى أكسيد البريليوم BeO وفق مخطط التفاعل الآتي:
ثم يُرجع الأكسيد BeO بالكربون في الدرجة 1400ْس.
المركبات
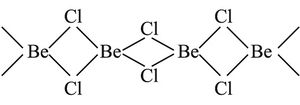
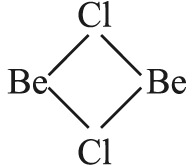
يشكل البريليوم مع الهالوجينات هاليدات من النموذج (I,Br , Cl , F , =X) BeX2. ويستحصل ثنائي فلوريد البريليوم BeF2 بالتفكك الحراري لرباعي فلوروبريلات الأمونيوم (NH4)2BeF4. وثنائي فلوريد البريليوم مادة صلبة، بُنْيتها غير منتظمة زجاجية القوام وماصة للرطوبة وجيدة الانحلال في الماء. ويستحصل ثنائي كلوريد البريليوم BeCl2 بتمرير CCl4 على أكسيد البريليوم BeO في الدرجة 800ْس. وكلوريد البريليوم مادة صلبة ذات بنية متبلمرة مؤلفة من السلاسل:
ويكون التساند coordination حول ذرة البريليوم رباعي وجوهٍ غير منتظم إذ تَحصر المستويات المتماسة:
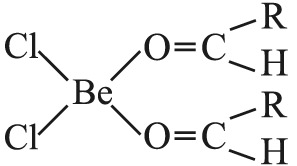
معاً زاوية قدرها 90ْ وتكون قيمة الزاوية في الرابطة Cl-Be-Cl 89ْ، وهي بخلاف قيمة الزاوية 109.5ْ في رباعي الوجوه المنتظم. ويقوم ثنائي الكلوريد BeCl2 بدور حمض لويس، لذا فالمركبات المانحة للأزواج الإلكترونية كالألدهيدات والسيتونات والإترات تساند الهاليد اللامائي BeCl2، BeBr2 وBeI2:
ويشكل ثنائي كلوريد البريليوم BeCl2 أملاحاً مضاعفة كثيرة، مثال ذلك Na2BeCl4، غير أن الأيون [BeCl4]2- لا يكون ثابتاً في المحلول بخلاف الأيون [BeF4]2-. ويُعْرف ثنائي كلوريد البريليوم بالشكل المائي BeCl2.4H2O، وهو يشكل مع النشادر معقداً complex ثابتاً هو ثنائي كلوريد رباعي أمّين البريليوم [Be(NH3)4]Cl2، ويشكل مع إيتلين ثنائي الأمين H2NCH2<نص الحرف السفلي/sub>CH2NH2 معقّد ثنائي كلوريد ثنائي الإيتلين ثنائي أمين البريليوم Be(en)]Cl2]. ويكون العدد التساندي في المعقدات التي يُشكلها الأيون Be2+ غالباً 4.
نظائره

للبريليوم نظير واحد مستقر هو Be-9 .والنظير المشع النادر Be-10، ينتج في الجو عن طريق التشظي النووي (الانقسام) للاوكسيجين والنيتروجين بالاشعاعات الكونية. بسبب ميول البريليوم للتواجد في المحاليل ذات درجات الحموضة pH التي تقل عن 5.5 (معظم مياه الامطار لها قياس حموضة يقل عن 5) ، فان البريليوم يدخل في مياه الامطار وينزل إلى الارض . وعندما تصبح درجة حموضة المطر اكثر قاعدية (قلوية) عند وصولها الارض ، ينفصل البريليوم عن المحلول (المطر) . وبذلك يتجمع النظير المشع النادر Be-10 في الطبقات السطحية للتربة ، حيث ان طول عمره النصفي الاشعاعي (1.5 مليون سنة) يسمح له بالتواجد لفترة طويلة قبل اضمحلاله الاشعاعي إلى البورون (B-10) ، حيث تسخدم فحوص تركيز النظير Be-10 ، ونواتج اضمحلاله الاشعاعي لملاحظة انجرافات التربة ، تكوّن التربة الغضارية ، وتكون التربة من خلال عوامل الحت والتعرية ، التقلبات الارضية (زلازل وبراكين) وتأثير الكائنات الحية ، كما تعتبر مؤشرا على تغيرات نشاط الشمس ولتقدير عمر عينات الجليد (في الاقطاب والانهار الجليدية).
ان حقيقة كون نظائر البريليوم Be-7 و Be-8 غير مستقرة له نتائج كونية مهمة لانه يعني ان العناصر الاثقل من البريليوم لا يمكن ان تكون قد تكونت بالانشطار النووي في الانفجار العظيم لما ولد الكون. وعلاوة على ذلك، فان مستويات الطاقة لدى البريليوم-8 مناسبة لتَكوّن الكربون في النجوم ، وبالتالي فبدون هذه الخاصية فان وجود الحياة (التي يعتبر الكربون جزء اساسي لوجودها) لن يكون ممكنا.
استخداماته
- يستخدم البريليوم كعنصر اشابة لانتاج سبائك نحاس مع البريليوم المسماة برونز البريليوم . ويتميز البريليوم بحرارته النوعية العالية ، مما يجعل سبائل نحاس البريليوم تستخدم بشكل واسع بسبب موصليتها الحرارية والكهربائية العالية ، قساوتها وتحملها للشد (strong) ، خصائصها اللامغناطيسية بالاضافة إلى مقاومتها الجيدة للتآكل والكلال . وتجعل هذه السبائك تستخدم لصنع مسرى اللحام النقطي ، النوابض (الزنبركات) ة والملامسات الكهربائية والادوات التي لا يسمح لها ان تصدر الشرار عند اصطدامها بحجر او فلز ، كالآلات اللازمة للعمل في الاجواء المعرضة للانفجار كالمناجم ومصانع البارود ومستودعات النفط.
- بسبب تصلبها ، وزنها الخفيف وثبات ابعادها ضمن مجال عريض من درجات الحرارة (قلة تأثرها بظاهرة التمدد والتقلص) ، فان سبائك نحاس البريليوم تستخدم ايضا في الصناعات الدفاعية وابحاث الفضاء كمواد هيكلية خفيفة الوزن في الطائرات ذات السرعة العالية ، الصواريخ ، مركبات الفضاء واقمار الاتصالات الصناعي.
- رقائق البريليوم تستخدم مع كشوف التشخيص التي تستخدم اشعة اكس (الاشعة السينية او اشعة رونتجن) ، فتمنع مرور الضوء المرئي وتسمح فقط لاشعة اكس بالمرور وذلك بنفاذية عالية تبلغ سبع عشر ضعف الالمنيوم الذي كان يستخدم لهذا الغرض سابقا.
- في مجال الحفر باشعة اكس ، يستخدم البريليوم لاستنساخ الدوائر الكهربائية المتناهية في الصغر.
- ان التقاط البريليوم للنيوترونات ضئيل ، فهو يشتتها ويغير اتجاه حركتها كما يبطيء من سرعتها لدرجة تجري عندها التفاعلات النووية المتسلسلة بشكل اكثر فعالية ، فيصد النيوترونات ويعيدها إلى المنطقة الفعالة من المفاعل ويحول دون تسربها من هناك ، كما ان ثباته الاشعاعي لا يتغير في درجات الحرارة العالية.
- يستخدم البريليوم ايضا في الجيروسكوبات (gyroscopes) اي الاجهزة الداخلة في في انظمة توجيه وحفظ توازن الصواريخ وسفن الفضاء والأقمار الصناعية ، كما يدخل في اجهزة الحاسوب وملحقاتها ، نوابض الساعات والادوات الاخرى التي يعتبر فيها خفة الوزن والصلابة وثبات الابعاد صفات مهمة ومرغوبة.
- يستخدم اكسيد البريليوم في العديد من التطبيقات التي تحتاج إلى نقل حراري ممتاز ، وصلابة وقوة عاليتين ، ودرجات انصهار عالية ، والتي تخدم كعوازل كهربائية.
- كانت مركبات البريليوم تستخدم في الاضائة الفلوريسنتية ،ولكن ذلك لم يستمر بسبب اصابة العاملين في تلك الصناعة بامراض سببها استنشاقهم للبريليوم بكميات زائدة (berylliosis).
- من المتوقع ان يكون لمسبار الفضاء المسمى جيمس ويب مرآة من البريليوم ، لانه سيكون في ظروف حرارية تصل إلى -240 سيلسيوس (30 كيلفن) ، ويمكن ان تعمل مرآة البريليوم بشكل افضل من المرايا الزجاجية في تلك الضروف الباردة بحيث تظل اكثر دقة واقل عرضة لتغير الشكل في درجات الحرارة تلك.
تحذيرات
البريليوم واملاحه مركبات سامة ، وتعتبر مسرطنة (مسببة للسرطان) . ومرض البريلليوسيس المزمن (Chronic berylliosis) هو مرض رئوي يسبب تكيسات في الرئة سببه التعرض للبريليوم لفترات طويلة فظهر في اوروبا والولايات الامريكية المتحدة في اواسط النصف الاول من القرن الماضي .
كان العاملون في مصانع المصابيح الفلورسنتية يصابون بالمرض جراء تعرضهم للبريليوم ، وبالرغم ان استخدامه في هذه الصناعة توقف في 1949 في الولايات الامريكية المتحدة ، الا ان العاملين في مجالات الصناعات النووية والفضاء بسبب استخدامهم لسبائك تحتوي البريليوم ، صناعة الاجهزة الالكترونية وغيرها ، لا زالو يتعرضون للاصابة بامراض يسببها البريليوم.
كان الباحثون الاوائل يتذوقون البريليوم ومركباته المختلفة ليتأكدوا من وجوده ، حيث انه يتميز بطعم حلو ، الا ان تشخيص وجوده يتم اليوم باجهزة متطورة تجنب الباحثين خطر دخول البريليوم إلى الجسم ، ويجب التعامل مع البريليوم ونقله بحذر للحيليولة دون انتشاره الخطر ، وبالتالي يجب التعامل معه باتباع التعليمات المناسبة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
مراجع
البريليوم من ويكيبيديا الانجليزية
المصادر
- ^ "Beryllium: Beryllium(I) Hydride compound data" (PDF). bernath.uwaterloo.ca. Retrieved 2007-12-10.
- ^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 14.48. ISBN 1439855110.
- ^ محمد علي المنجد. "البريليوم". الموسوعة العربية. Retrieved 2012-04-19.
- Los Alamos National Laboratory - Beryllium
- Burrell, AK. Ehler, DS. McClesky, TM. Minogue, EM. Taylor, TP. Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces. Journal of ASTM International (JAI). 2005. Vol 2: Issue 9. http://www.astm.org/cgi-bin/SoftCart.exe/JOURNALS/JAI/PAGES/JAI13168.htm?E+mystore
- Infante PF, Newman LS. "Commentary: Beryllium exposure and Chronic Beryllium Disease." Lancet 2004; 415-16.
- Newman LS. "Beryllium." Chemical & Engineering News, 2003; 36:38.
- Kelleher PC, Martyny JW, Mroz MM, Maier LA, Ruttenber JA, Young DA, Newman LS. "Beryllium particulate exposure and disease relations in a beryllium machining plant." J Occup Environ Med 2001; 43:238-249.
- Mroz MM, Balkissoon R, Newman LS. "Beryllium." In: Bingham E, Cohrssen B, Powell C (eds.) Patty’s Toxicology, Fifth Edition. New York: John Wiley & Sons 2001, 177-220.
- Beryllium and Compounds: TLV® Chemical Substances Draft Documentation, Notice of Intended Change ACGIH® Publication #7NIC-042
مراجع للإستزادة
- أحمد الحاج سعيد ومحمد علي المنجد، الكيمياء اللاعضوية (2) (جامعة دمشق 1984-1985).
- مجلة العربي (الكويت) العدد350 كانون الثاني 1988.
- R.B.Helsop, K. Jones A Guide to Advanced Study (Elsevier Scientific Publishing Company, Amsterdam 1976).